01.10.2024 Kinderchirurgie
Wie versorgen wir die Appendizitis in der Zukunft?
Die derzeitigen etablierten Methoden und Empfehlungen zur Therapie der akuten Appendizitis gehen auf Arbeiten zurück, die bereits mehr als 130 Jahre alt sind. Als sehr einflussreich gelten die Empfehlungen des amerikanischen Pathologen Reginald H. Fitz zur grundsätzlichen und raschen chirurgischen Entfernung des entzündeten Wurmfortsatzes, die immer noch das chirurgische Handeln bestimmen [1].
Wissenschaftliche Aktivitäten mit dem Gegenstand der akuten Appendizitis haben sich seither in erster Linie auf chirurgisch praktische Fragestellungen vor dem Hintergrund der allgemein akzeptierten und grundsätzlich angewendeten Methode der Appendektomie konzentriert. Auch wenn Erkenntnisse zu methodischen Aspekten wie der Anwendung von Drainagen, der intraabdominalen Spülung und dem Operationszeitpunkt eine große Anzahl untersuchter Patienten notwendig machen, existieren dahingehend mittlerweile tragfähige Empfehlungen [2]. Diese Erkenntnisse sind wichtig, denn sie bestimmen das derzeitige Handeln. Es handelt sich jedoch im Wesentlichen um Modifikationen des Bestehenden, sodass sich auf dieser Basis die zukünftige Behandlung der akuten Appendizitis möglicherweise nur unzureichend voraussagen lässt.
Neben den rein praktischen Aspekten der Behandlung der akuten Appendizitis existieren im Hintergrund drei Entwicklungen, die wahrscheinlich das zukünftige Handeln bestimmen werden:
- die Klärung der Pathophysiologie der akuten Appendizitis,
- Studien zur diagnostischen Anwendung von Methoden der künstlichen Intelligenz (KI) und des maschinellen Lernens (ML) und
- Studien zur konservativen Therapie der akuten Appendizitis.
Diese Entwicklungen sind inhaltlich stark miteinander verwoben, so müssen sich Methoden der KI mit dem Ziel der Diagnose der Appendizitis oder gar unterschiedlicher Ausprägungen der Entzündung notwendigerweise auf pathophysiologische Faktoren beziehen. Die konservative Therapie ist wiederum auf die eindeutige Diagnose der Appendizitis und sogar der Schweregrade angewiesen, was wieder zur Pathophysiologie zurückführt. In diesem Artikel sollen die genannten drei Entwicklungen, die bisher weitestgehend isoliert betrachtet wurden, anhand von prägnanten Beispielen im Zusammenhang dargestellt werden. Rein inhaltlich sind die Entwicklungen im Fluss, sodass sich daraus noch keine verlässlichen diagnostischen oder therapeutischen Strategien ableiten lassen. Die Zukunft der Behandlung der akuten Appendizitis zeichnet sich jedoch möglicherweise bereits ab.
Die konservative Behandlung der akuten Appendizitis
Im Zentrum der Überlegungen zur zukünftigen Behandlung der akuten Appendizitis stehen die verschiedenen therapeutischen Alternativen – insbesondere chirurgisch operativ vs. (antibiotisch) konservativ. Es gibt mittlerweile einige entsprechende Studien aus dem erwachsenenchirurgischen und kinderchirurgischen Bereich. Die erste kinderchirurgische prospektiv-randomisierte Studie, in der die antibiotisch-konservative Behandlung mit der etablierten chirurgischen Therapie verglichen wurde, wurde am Karolinska Universitätskrankenhaus in Stockholm durchgeführt [3]. Im Rahmen der Machbarkeitsstudie wurde eine limitierte Anzahl von 49 Kindern mit nicht-perforierender Appendizitis nach entsprechender bildgebender Diagnose mittels Sonographie oder Computertomographie (CT) für die entsprechenden Methoden randomisiert. Die Studie ist allerdings auch hinsichtlich der Probleme und insbesondere des Therapieversagens der konservativen Behandlung repräsentativ. So ergab eine Auswertung nach fünf Jahren ein Versagen der konservativen Therapie (entsprechend einer sekundären Appendektomie von primär konservativ behandelten Patienten) von 46 % (11 der 24 konservativ behandelten Patienten) [4]. Tatsächlich liegt die Quote des Therapieversagens in den verschiedenen insbesondere randomisiert-kontrollierten Studien bei 40 %, sodass derzeit keine entsprechende Empfehlung gegeben werden kann [5].
Im Zentrum steht die Frage, welche entzündlichen Entitäten für die konservative Therapie geeignet sind. Tatsächlich wurde die aktuell fehlende Möglichkeit der zuverlässigen präoperativen Differenzierung zwischen unkomplizierter und komplizierter Appendizitis als zentrales Hindernis für die konservative Therapie ausgemacht [5]. Hinsichtlich der Definition der Begriffe der unkomplizierten und komplizierten Inflammation tut sich ein weiteres Problem auf. So steht traditionell und aktuell immer die Perforation der Appendix – also der transmurale Substanzdefekt durch nekrotischen Gewebsuntergang – für die Definition der komplizierten Appendizitis im Vordergrund. Das ist insbesondere dahingehend verständlich, dass die Perforation häufig mit einem schlechteren Outcome mit Wundheilungsstörungen und Abszessen bis hin zur Sepsis und einer Mortalitätsrate von bis zu 5 % einhergeht [2].
Tatsächlich finden sich komplizierte Verläufe allerdings bereits gehäuft auf der Ebene der nicht perforierenden gangränösen Inflammation, die durch eine transmurale Nekrose ohne Substanzdefekt charakterisiert ist [6]. So ist die gangränöse Appendizitis klinisch durch eine gegenüber der unkomplizierten histopathologisch nicht nekrotisierenden phlegmonösen Entzündung durch eine höhere Rate an Komplikationen wie Wundinfektionen, Darmdysmotilität, Abszessbildungen und eine 6-fach erhöhte Mortalität gekennzeichnet [2, 6]. Die Vermutung liegt nahe, dass die Patient:innenstratifizierung für die konservative vs. chirurgische Behandlung auf dieser Ebene stattfinden sollte. Eine entsprechende Unterscheidung wurde bisher in keiner vergleichenden Therapiestudie zugrunde gelegt, was möglicherweise zu den hohen Versagensquoten in den konservativen Studienarmen geführt hat. Allerdings ist es derzeit mit keinem der etablierten klinischen, bildgebenden oder laborchemischen Verfahren möglich, phlegmonöse und gangränöse Appendizitis präoperativ zuverlässig zu unterscheiden. Dies kennzeichnet das aktuell noch grundsätzliche bestehende Problem der konservativen Behandlung.
Die konservative Therapie hat derzeit noch kein Fundament im Sinne einer geklärten Pathophysiologie, die eine Patient:innenstratifizierung auf Basis sinnvoller und präoperativ sicher differenzierbarer Krankheitsentitäten möglich macht.
Die Pathophysiologie der akuten Appendizitis
Auch wenn aktuell noch keine abschließend geklärte Pathophysiologie der akuten Appendizitis angeboten werden kann, scheinen dahingehend tatsächlich unterschiedliche Voraussetzungen für die phlegmonöse und die gangränöse/perforierende Entzündung vorzuliegen.
So konnte speziell im Falle einer gangränösen Entzündung die schwedische Arbeitsgruppe um Andersson eine signifikant erhöhte Sekretion von Zytokinen nachweisen, welche mit einer Typ1-T-Helferzellen (Th1) und Th17-vermittelten Immunreaktion einhergehen [7, 8]. Das von Th17-Zellen freigesetzte Interleukin (IL-)17 ist ein stark wirksames proinflammatorisches Zytokin und mit der Rekrutierung von Neutrophilen Granulozyten in entzündetes Gewebe assoziiert [9, 10]. Überdies wurden erhöhte IL-17-Werte bereits mit E.-coli-Infektionen in Verbindung gebracht, was wiederum das am häufigsten nachweisbare bakterielle Pathogen bei der kindlichen Appendizitis darstellt [10]. Umgekehrt haben appendektomierte Patient:innen ein signifikant niedrigeres Risiko eine chronisch entzündliche Darmerkrankung zu entwickeln. Ursächlich dafür wird eine Suppression der Th-17-vermittelten Immunantwort angenommen [11]. Hinweise für eine Th2-abhängige Immunantwort im Falle der phlegmonösen Appendizitis korrespondieren mit dem Nachweis einer im Vergleich zeitlich stabil im Mittel signifikant höheren Zahl an eosinophilen Granulozyten [7, 12, 13].
Unabhängig davon gibt es deutliche Hinweise für eine virale Genese der akuten Appendizitis [14–16]. Dies stellt nicht unbedingt einen Widerspruch zu der Beobachtung Th1- und Th2-abhängiger Immunmechanismen dar, da gerade virale Infektionen einen entsprechenden Shift verursachen können [17].
Für praktische Fragen hinsichtlich der zukünftigen Versorgung der akuten Appendizitis ist unabhängig von der genauen Pathophysiologie die Feststellung wichtig, dass es sehr wahrscheinlich Formen der Entzündung gibt, die unterschiedlich – konservativ oder operativ – behandelt werden können. Die Herausforderung besteht nun in der zuverlässigen Unterscheidung für eine sichere therapeutische Zuordnung. Hier bieten sich Methoden der künstlichen Intelligenz (KI) und insbesondere des maschinellen Lernens (ML) an, um auf der Basis umfangreicher Daten und komplexer Zusammenhänge sogenannte Biomarkersignaturen zu erstellen, die als die kleinstmögliche Kombination entsprechender Parameter mit der größtmöglichen differenzierenden Aussagekraft definiert sind.
Die diagnostische Anwendung künstlicher Intelligenz
Beispielhaft sollen zwei Studien erwähnt werden, die das Ziel hatten, im Sinne einer Machbarkeitsuntersuchung Biomarkersignaturen zur Differenzierung von phlegmonöser und gangränöser/perforierender Appendizis auf Basis unterschiedlicher Daten zu erstellen und zu überprüfen. So wurden Methoden des ML auf Blutbildparameter, C-reaktives Protein und sonographisch gemessene Appendixdurchmesser angewendet. Die erstelle Biomarkersignatur zeigte eine gute Differenzierbarkeit der entzündlichen Entitäten (Abb. 1) [18]. Die Anwendung entsprechender Methoden auf Genexpressionsdaten aus peripheren Blutzellen erkrankter Patient:innen zeigte ebenfalls im Rahmen eines Proof-of-Concepts eine gute Effektivität hinsichtlich der Unterscheidung der Entitäten (Abb. 2) [19].
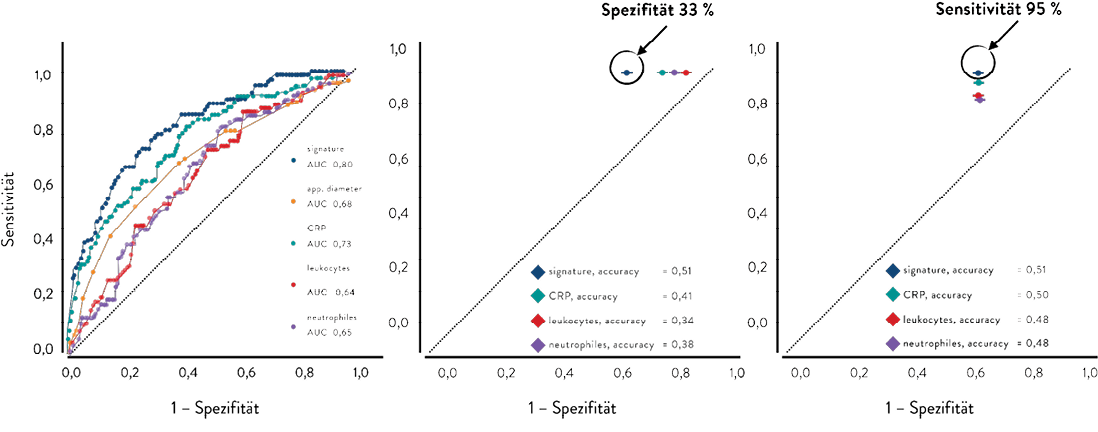
Abb. 1: Receiver operating characteristic curve zur Demonstration der Effektivität einer Biomarkersignatur auf Basis von Blutbildparametern und sonographisch gemessenem Appendixdurchmesser zur Unterscheidung von phlegmonöser und gangränöser Appendizitis insbesondere an einem „point of interest“ mit hoher Sensitivität [18]. N = 590. Biomarkersignatur: basophile Granulozyten, eosinophile Granulozyten, Monozyten, Thrombozyten, C-reaktives Protein, sonographisch gemessener Appendixdurchmesser. AUC: Area under the curve.

Abb. 2: Receiver operating characteristic curve zur Demonstration der Effektivität einer Biomarkersignatur auf Basis Genexpressionsparametern zur Unterscheidung von phlegmonöser und gangränöser Appendizitis [19]. N = 29. Biomarkersignatur: ERGIC and golgi 3, Regulator of G-protein signalling 2, Rho GTPase activation protein 33, Golgi Reassembly Stacking Protein 2. AUC (area under the curve): 0,84 (0,08). Die Datengrundlage wurde mittels des Bootstrap-Verfahrens vergrößert.
Somit scheint die Entwicklung von Biomarkersignaturen eine effektive Möglichkeit zu sein, inflammatorische Entitäten der akuten Appendizitis im Kindesalter präoperativ für unterschiedliche Behandlungsmethoden zu differenzieren.
Zusammenfassung
Die konservative Therapie erweitert theoretisch das Spektrum der Behandlungsoptionen für die akute Appendizitis bei Kindern und Erwachsenen. Allerdings lassen sich geeignete Patient:innen mit den derzeit etablierten diagnostischen Möglichkeiten nicht abgrenzen, da insbesondere die Pathophysiologie der unterschiedlich zu behandelnden inflammatorischen Formen nicht ausreichend geklärt ist, um objektive differenzierende Parameter zu definieren. Perspektivisch wird es möglich sein, mittels Methoden der künstlichen Intelligenz differenzierende Biomarkersignaturen zu entwickeln, die in Zukunft eine sichere Anwendung konservativer Therapiemethoden geeigneter Patient:innen ermöglichen.
Literatur
[1] Fitz RH. Perforating inflammation of the vermiform appendix: with special reference to its early diagnosis und treatment. Am J Sci 1886;92:321-46.
[2] Di Saverio S, Podda M, De Simone B, Ceresoli M, Augustin G, Gori A, et al. Diagnosis and treatment of acute appendicitis: 2020 update of the WSES Jerusalem guidelines. World J Emerg Surg 2020;15:27. doi: 10.1186/s13017-020-00306-3.
[3] Svensson JF, Patkova B, Almström M, Naji H, Hall NJ, Eaton S, Pierro A, Wester T. Nonoperative treatment with antibiotics versus surgery for acute nonperforated appendicitis in children: a pilot randomized controlled trial. Ann Surg 2015;261:67-71. doi: 10.1097/SLA.0000000000000835. PMID: 25072441.
[4] Patkova B, Sevenningsson A, Almström M, Eaton S, Wester T, Svensson JF. Nonoperative treatment versus appendectomy for acute nonperforated appendicitis in children: five-year follow up of a randomized controlled pilot trial. Ann Surg 2020; 271: 1030-35. doi: 10.097/SLA.0000000000003646.
[5] Kirby A, Hobson RP, Burke D, Cleveland V, Ford G, West. Appendicectomy for suspected uncomplicated appendicitis is associated with fewer complications than conservative antibiotic management: a meta-analysis of post-intervention complications. J Infect 2015;70: 105-10. doi: 10.1016/j.jinf.2014.08.009.
[6] Bhangu A, Søreide K, Di Saverio S, Assarsson JH, Drake FT. Acute appendicitis: modern understanding of pathogenesis, diagnosis, and management. Lancet 2015;386:1278-87. doi: 10.1016/S0140-6736(15)00275-5.
[7] Rubér M, Berg A, Ekerfelt C, Olaison G, Andersson RE. Different cytokine profiles in patients with a history of gangrenous or phlegmonous appendicitis. Clin Exp Immunol 2006;143:117–24. doi: 10.1111/j.1365-2249.2005.02957.x
[8] Rubér M, Andersson M, Petersson BF, Olaison G, Andersson RE, Ekerfelt C. Systemic Th17-like cytokine pattern in gangrenous appendicitis but not in phlegmonous appendicitis. Surgery 2010;147:366–72. doi: 10.1016/j.surg.2009.09.039
[9] Shibata K, Yamada H, Hara H, Kishihara K, Yoshikai Y. Resident Vdelta1+ gammadelta T cells control early infiltration of neutrophils after Escherichia coli infection via IL-17 production. J Immunol 2007;178:4466-72. doi: 10.4049/jimmunol.178.7.4466. PMID: 17372004.
[10] Richardsen I, Schöb DS, Ulmer TF, Steinau G, Neumann UP, Klink CD, Lambertz A. Etiology of Appendicitis in Children: The Role of Bacterial and Viral Pathogens. J Invest Surg 2016;29:74-9. doi: 10.3109/08941939.2015.1065300. Epub 2015 Sep 16. PMID: 26376211.
[11] Sarra M, Pallone F, Macdonald TT, Monteleone G. IL-23/IL-17 axis in IBD. Inflamm Bowel Dis 2010;16:1808-13. doi: 10.1002/ibd.21248. PMID: 20222127.
[12] Minderjahn MI, Schädlich D, Radtke J, Rothe K, Reismann M. Phlegmonous appendicitis in children is characterized by eosinophilia in white blood cell counts. World J Pediatr 2018;14:504-9. doi: 10.1007/s12519-018-0173-3.
[13] Reismann J, Schädlich D, Minderjahn MI, Rothe K, Reismann M. Eosinophilia in pediatric uncomplicated appendicitis is a time stable pattern. Pediatr Surg Int 2019;35:335-40. doi: 10.1007/s00383-018-4423-1.
[14] Kiss N, Minderjahn M, Reismann J, Svensson J, Wester T, Hauptmann K, Schad M, Kallarackal J, von Bernuth H, Reismann M. Use of gene expression profiling to identify candidate genes for pretherapeutic patient classification in acute appendicitis. BJS Open 2021;5:zraa045. doi: 10.1093/bjsopen/zraa045.
[15] Alder AC, Fomby TB, Woodward WA, Haley RW, Sarosi G, Livingston EH. Association of viral infection and appendicitis. Arch Surg 2010;145:63-71. doi: 10.1001/archsurg.2009.250.
[16] Lamps LW. Infectious causes of appendicitis. Infect Dis Clin North Am 2010;24:995-1018, ix-x. doi: 10.1016/j.idc.2010.07.012.
[17] Howard FHN, Kwan A, Winder N, Mughal A, Collado-Rojas C, Muthana M. Understanding Immune Responses to Viruses-Do Underlying Th1/Th2 Cell Biases Predict Outcome? Viruses 2022;14:1493. doi: 10.3390/v14071493.
[18] Reismann J, Romualdi A, Kiss N, Minderjahn MI, Kallarackal J, Schad M, Reismann M. Diagnosis and classification of pediatric acute appendicitis by artificial intelligence methods: An investigator-independent approach. PLoS One 2019;14:e0222030. doi: 10.1371/journal.pone.0222030.
[19] Reismann J, Kiss N, Reismann M. The application of artificial intelligence methods to gene expression data for differentiation of uncomplicated and complicated appendicitis in children and adolescents – a proof of concept study. BMC Pediatr 2021;21:268. doi: 10.1186/s12887-021-02735-8.

Korrespondierender Autor:
PD Dr. med. Marc Reismann
Klinik für Kinderchirurgie
Charité – Universitätsmedizin Berlin
Augustenburger Platz 1
13353 Berlin

Dr. med. Maximiliane Minderjahn
Klinik für Kinderchirurgie
Charité – Universitätsmedizin Berlin
Chirurgie
Reismann M, Minderjahn M: Wie versorgen
wir die Appendizitis in der Zukunft?
Passion Chirurgie. 2024 Oktober;
14(10): Artikel 03_03.
Mehr Artikel zur Kinderchirurgie finden Sie auf BDC|Online (www.bdc.de) unter der Rubrik Wissen | Fachgebiete | Kinderchirurgie.
Weitere Artikel zum Thema
15.10.2024 BDC|News
Passion Chirurgie: Kinder- und Jugendchirurgie im Fokus
In der heutigen Ausgabe spielen die aktuellen Entwicklungen der Kinder- und Jugendchirurgie eine besondere Rolle. Im Fokus stehen die Zentralisierung spezieller Krankheitsbilder, die Entwicklung in der Laparoskopie..
01.10.2024 Kinderchirurgie
Zentralisation der Gallengangatresie in Deutschland – Eine Initiative der DGKCH
Die Gallengangatresie (syn. Biliäre Atresie/engl. Biliary Atresia [BA]) ist eine seltene obstruktive Cholangiopathie der Neugeborenenperiode unklarer Ätiologie (Abb. 1), die innerhalb kürzester Zeit zu einer fortschreitenden Leberfibrose sowie -zirrhose führt. Trotz einer Inzidenz von knapp 1:19.000 in Deutschland, mit ca. 35 bis 40 neuen Diagnosen pro Jahr, macht die BA global immer noch die häufigste Ursache für eine Lebertransplantation im Kindesalter aus.
01.10.2024 Kinderchirurgie
Stellenwert der roboterassistierten Chirurgie im Kindes- und Jugendalter
Kinderchirurgie ist bekanntermaßen nicht die Chirurgie zu klein geratener Erwachsener und doch gab es in der Vergangenheit einige Entwicklungen der Erwachsenenchirurgie, die in der Kinderchirurgie adaptiert wurden. Zu den letzten großen Entwicklungen auf dem Gebiet der Chirurgie zählt sicherlich die roboterassistierte Chirurgie.
01.10.2024 BDC|News
Editorial: Kinder- und Jugendchirurgie
In dieser Ausgabe liegt der Schwerpunkt auf dem Bereich der Kinder- und Jugendchirurgie. Unsere Gesellschaft hat die Umbenennung in die Deutsche Gesellschaft für Kinder- und Jugendchirurgie zu unserem 60. Geburtstag 2023 bereits beschlossen und die dadurch notwendige Änderung der Satzung bei der diesjährigen Mitgliederversammlung im April in Leipzig bestätigt. Sobald die Änderungen im Vereinsregister erfolgt sind, werden wir uns Deutsche Gesellschaft für Kinder- und Jugendchirurgie (DGKJCH) nennen.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.






















