01.11.2024 Viszeralchirurgie
Magdeburger Pancreaszystenpass
NUTZEN DER REGISTER-BASIERTEN SYSTEMATISCHEN ERFASSUNG VON ZYSTISCHEN PANKREASNEOPLASIEN
Durch die vermehrte Anwendung leistungsstarker bildgebender Verfahren mit sukzessive gesteigerter Auflösung wie der Computertomographie (CT) und insbesondere der Magnetresonanztomographie (MRT) werden zystische Veränderungen in der Bauchspeicheldrüse zunehmend häufiger entdeckt. In einer deutschen prospektiven, bevölkerungsbasierten Kohortenstudie aus Pommern wurden 1.077 Teilnehmer mittels MRT und Magnetresonanz-Cholangiopankreatikographie (MRCP) untersucht. Die Studie zeigte eine Prävalenz von Pankreaszysten von 49,1 % in der Bevölkerung mit einem starken Zusammenhang zum Alter der Proband:innen. Die überwiegende Mehrheit dieser Zysten war harmlos, wobei nur 5,8 % der Zysten größer als 1 cm waren [1]. Eine separate amerikanische Studie ergab, dass die Inzidenz zufällig entdeckter Zysten zwischen 2010 und 2017 um das Dreifache angestiegen war [2]. Angesichts dieser epidemiologischen Zahlen ist eine korrekte Interpretation erforderlich, um sowohl unnötige Therapiemaßnahmen als auch unnötig engmaschige Verlaufskontrolluntersuchungen zu vermeiden, die sowohl eine deutliche wirtschaftliche Belastung für das Gesundheitssystem als auch eine erhebliche psychologische Belastung für die Patient:innen bedeuten würden.
Ziel des Manuskripts ist es, basierend auf den aktuellen Erkenntnissen zu zystischen Pankreasläsionen die Sinnhaftigkeit und den Nutzen einer Register-basierten Erfassung derartiger Pankreasneoplasien darzustellen.
Methode
Narrative Kurzübersicht anhand selektiver Referenzen der themenbezogenen aktuellen medizinisch-wissenschaftlichen Literatur und eigener klinischer Managementerfahrungen.
ERGEBNISSE (Eckpunkte)
Überblick über die zystischen Neoplasien des Pankreas
Zystische Neoplasien der Bauchspeicheldrüse umfassen eine sehr heterogene Gruppe von Pankreaszysten bzw. Pankreas-assoziierten zystischen Läsionen mit unterschiedlichen Risiken für eine Entartung. Daher ist eine korrekte Befundinterpretation von großer Bedeutung.
Seröses Zystadenom (SCN)
SCN bestehen hauptsächlich aus Mikrozysten, die keine Verbindung zum Pankreasgang haben. Sie treten häufig bei Frauen im mittleren Lebensalter auf und sind in der Regel gutartig. Das mikrozystische und wabenförmige Erscheinungsbild in der Bildgebung ist ein diagnostisches Zeichen für ein SCN. Ein kleiner Prozentsatz der SCNs kann oligozystisch, makrozystisch oder seltener unilokular sein. Wenn kein mikrozystisches Erscheinungsbild vorhanden ist, wird ein niedriger Gehalt an karzinoembryonalem Antigen (CEA) in der Zystenflüssigkeit als spezifisch für SCN angesehen [3]. Die Resektion ist nur im Falle einer raschen Größenzunahme sowie bei auftretenden Symptomen angezeigt. Andernfalls werden die Läsionen über ein Jahr verlaufskontrolliert und bei stabilem Befund dann nur im Falle von klinischen Beschwerden erneut evaluiert [4].
Solid-pseudopapilläre Neoplasien (SPN)
SPN sind seltene Tumoren, die meist junge Frauen in der dritten oder vierten Lebensdekade betreffen. SPN präsentieren sich in der Schnittbildgebung typischerweise als heterogene, gut umschriebene Läsionen mit zum Teil zystischen und zum Teil soliden Anteilen. Dies ist auf ausgedehnte Blutungen und Nekrosen im Inneren zurückzuführen [5]. Sie weisen ein geringes bösartiges Tumorpotenzial auf. Die Rezidivrate nach R0-Resektion beträgt etwa 1,5 % und korreliert nicht mit der Tumorgröße, sondern mit histologischen Eigenschaften wie
•einem infiltrativen Wachstumsmuster,
•einer Invasion des Pankreasparenchyms
•einer Kapselinvasion.
Lymphknotenmetastasen sind äußerst selten, daher ist eine parenchymsparende chirurgische Resektion hier die Therapie der Wahl [6, 7, 8].
Muzinös-zystische Neoplasien (MCN)
MCN betreffen fast ausschließlich Frauen und wachsen in der Mehrzahl in Pankreaskorpus und -schwanz. Es zeigen sich in der Bildgebung dickwandige Einzelzysten mit Septen und teilweise wandständigen Knoten, die mit Muzin gefüllt sind und keinen Anschluss zum Pankreasgang haben. Ein MRT soll immer von einer Endosonographie (EUS) gefolgt werden, da 18 % der MCN inkorrekt diagnostiziert werden [9].
MCNs haben das Potenzial, sich zu bösartigen Erkrankungen zu entwickeln über die Adenom-Karzinom-Sequenz. In großen Serien konnte gezeigt werden, dass 11 % der resezierten MCN eine invasive Komponente haben. Für die Praxis gilt: MCN > 4 cm sollten reseziert werden. Auch bei MCN < 4 cm wird im Falle von klinischen Symptomen oder Vorliegen von soliden Anteilen die Resektion empfohlen, da diese entsprechende Risikofaktoren für eine bösartige Entartung darstellen. Kleine asymptomatische MCN sollten mittels MRT und/oder EUS beobachtet werden. Die Verlaufskontrollen sollten 6-monatlich im ersten Jahr und daraufhin jährlich durchgeführt werden [4, 9].
Intraduktale papilläre muzinöse Neoplasien (IPMN)
IPMN sind muzinproduzierende zystische Strukturen mit Anbindung an das Pankreasgangsystem. Sie kommen in beiden Geschlechtern gleichermaßen vor, wobei die Inzidenz mit dem Alter steigt. IPMN sind die häufigsten zystischen Pankreasneoplasien und differenzieren sich je nach ihrer Lokalisation in Hauptgang-IPMN, Seitengang-IPMN und Mischtyp-IPMN. Hauptgang-IPMN und Mischtyp-IPMN zeigen in 34–39 % der Fälle ein invasives Wachstum und sollten daher chirurgisch reseziert werden [10, 11].
Seitengang-IPMN unterscheiden sich stark von Hauptgang-IPMN hinsichtlich ihres Entartungspotenzials. Eine umfangreiche Meta-Analyse hat gezeigt, dass Seitengang-IPMN eine Malignitätsrate von 2,7 % aufweisen und daher nur unter bestimmten Kriterien einer Operation zugeführt werden sollten [12].
Die aktuelle europäische Leitlinie unterscheidet zwischen absoluten und relativen Kriterien zur Einschätzung des Entartungspotenzials:
•Absolute Kriterien für die Operation („Hochrisiko-Eigenschaften“ – Literatur: „High-Risk-Stigmata“): Ikterus, solide Zystenanteile > 5 mm, Erweiterung des Pankreasganges auf über 1 cm oder positive Zytologie sind hochprädiktive Faktoren für Malignität und stellen daher eine absolute Indikation für die Operation dar.
•Relative Kriterien für die Operation („beunruhigende Eigenschaften“ – Literatur: „Worrisome Features“): Pankreasgangweite zwischen 5 und 9,9 mm, Größenprogredienz über 5 mm pro Jahr, erhöhtes CA 19-9, neu aufgetretene akute Pankreatitis oder Diabetes mellitus, solide Zystenanteile < 5 mm und/oder Zystengröße > 40 mm sind mit einem erhöhten Risiko von „High-Grade“-Dysplasie oder Malignität assoziiert und sind relative Indikationen für eine Operation. In diesen Fällen kann je nach Umfang des Eingriffs, den Patientenkomorbiditäten und den Wünschen der/s Patient:in eine Operation empfohlen werden. (Tab. 1).
Tab. 1: Kriterienliste für die Operation in Abhängigkeit von ihrem prädiktiven Wert
|
Kriterien für die Operation |
Eigenschaften |
Literatur- Bezeichnung |
prädiktive Faktoren |
|
absolut |
Hochrisiko |
„high-risk stigmata“ |
– Ikterus, – solide Zystenanteile > 5 mm, – Erweiterung des Pankreasganges auf über 1 cm, – positive Zytologie |
|
relativ |
„beunruhigend“ |
„worrisome features“ |
– Pankreasgangweite zwischen 5 und 9,9 mm, – Größenprogredienz über 5 mm pro Jahr, – erhöhtes CA 19-9, – neu aufgetretene akute Pankreatitis ODER Diabetes mellitus, – solide Zystenanteile < 5 mm UND / ODER – Zystengröße > 40 mm |
Falls weder absolute noch relative Kriterien für ein chirurgisches Vorgehen vorhanden sind, werden IPMNs als „Low Risk“ eingestuft. Große Beobachtungsstudien beschreiben, dass zwischen 20 % und 58 % aller Low-Risk-IPMN im Verlauf Worrisome Features oder High-Risk-Stigmata entwickeln können. Bis zu 9 % zeigen diese Veränderungen erst nach fünf Jahren der Überwachung und 4 % sogar erst nach 10 Jahren [13–16]. Aus diesem Grund sollten sie systematisch überwacht werden.
In letzter Zeit wurde die Bedeutung eines zusätzlichen Kriteriums betont, das ebenfalls in die Beurteilung einbezogen werden sollte: die Stabilität einer zystischen Läsion im Laufe der Zeit. Trotz des Vorhandenseins von Worrisome Features sind Zysten, die im Laufe der Zeit unverändert bleiben, weniger gefährlich als solche, die zu Beginn keine Risikokriterien aufweisen, aber während der Nachuntersuchung Worrisome Features oder High-Risk-Stigmata entwickeln. Letztere weisen signifikant auf ein erhöhtes Risiko hin, eine hochgradige Dysplasie oder ein Karzinom zu entwickeln [14]. Entscheidend ist es daher, sich einen umfassenden Überblick zu verschaffen und die verschiedenen Bilder, die durch die Verlaufskontrolle entstehen, zusammenzuführen, um damit eine Art fortlaufenden „Film“ zu erhalten, anstatt nur eine einzelne Momentaufnahme zu bewerten [17].
Diagnostisches Vorgehen
Das ultimative Ziel bei der Diagnose und Überwachung von zystischen Neoplasien der Bauchspeicheldrüse besteht darin, zu verstehen, welche Neubildungen sich letztendlich zu bösartigen Läsionen entwickeln können. Bei der Erstdiagnose ist die MRT mit MRCP die sensibelste Schnittbildgebung zur korrekten Beurteilung einer zystischen Neoplasie des Pankreas. Damit kann die Kommunikation zwischen einer Läsion und dem Pankreasgangsystem am besten beurteilt werden, ebenso wie das Vorhandensein eines randständigen Knotens. Darüber hinaus ist die MRT/MRCP sehr empfindlich, um festzustellen, ob ein(e) Patient:in einzelne oder multifokale Zysten aufweist [4].
Wenn nach einer CT- und/oder MRT-Untersuchung keine eindeutige Diagnose vorliegt, sollte eine EUS durchgeführt werden. Obwohl diese Untersuchung stark von der Erfahrung des Untersuchers abhängt, ist sie hilfreich zur Unterscheidung zwischen muzinösen und nichtmuzinösen Zysten sowie zur Bewertung von Worrisome Features und High-Risk-Stigmata (Tab. 1), die auf eine Malignität hinweisen können [18]. Zur Beurteilung von randständigen Knoten ist die Kontrast-EUS die bevorzugte Technik. Falls weiterhin Zweifel bestehen, ist die Feinnadelaspiration (FNA) zur Analyse der Zystenflüssigkeit notwendig, sofern dies technisch machbar ist. Die Analyse der Zystenflüssigkeit kann zur Identifizierung des Zystentyps verwendet werden. Dabei sind erhöhte CEA-Werte bei muzinproduzierenden Zysten mit einer Genauigkeit von 79 % verbunden, während erhöhte Amylasewerte eine Spezifität von über 90 % für eine Pseudozyste aufweisen [19].
Pankreaszysten: die Probleme der Praxis
Die derzeit verfügbaren klinischen Instrumente sind noch nicht in der Lage, Patient:innen mit Zysten die am besten geeigneten Behandlungsstrategien zuzuordnen und bei einem Drittel der Patient:innen, die operiert werden, wird letztlich festgestellt, dass sie keine hochgradige Dysplasie oder Krebs aufweisen [20]. Aufgrund der Schwierigkeit, hoch-risikoreiche Pankreaszysten zu erkennen, ist es für Kliniker eine große Herausforderung, in ihrer praktischen Arbeit ein Gleichgewicht zwischen dem Risiko einer chirurgischen Behandlung und dem tragischen Fehler der ausschließlichen Überwachung einer bösartigen Läsion herzustellen.
Auch die psychologischen Aspekte der Patient:innen dürfen nicht außer Acht gelassen werden. Die neu gestellte Diagnose einer zystischen Neubildung in der Bauchspeicheldrüse mit unklarem biologischen Verhalten sowie die regelmäßige Überwachung solcher Befunde können Ängste und Besorgnis hervorrufen, was zu erheblicher psychischer Belastung führen kann. Eine Studie hat verdeutlicht, dass Patient:innen, die aufgrund einer IPMN überwacht wurden, im Vergleich zu Patient:innen, die sich einer Operation unterzogen, signifikant verstärkte Symptome wie Somatisierung, Depression und Angst aufweisen [21]. Zweifellos besteht bei betroffenen Patient:innen das Bedürfnis nach Klarheit, weshalb eine umfassende und detaillierte Aufklärung von großer Bedeutung ist. Das beeinflusst nicht nur die gemeinsame Entscheidungsfindung hinsichtlich der Therapiestrategie, sondern auch maßgeblich die Lebensqualität der Betroffenen.
Ein weiteres erhebliches Problem, das sich häufig in der Praxis zeigt, ist der Verlust relevanter Informationen. Patient:innen, die überwacht werden sollen, erhalten je nach Einschätzung des Zystenrisikos eine bildgebende Untersuchung (MRT oder Endosonographie) alle drei, sechs oder 12 Monate. Die Überwachung zystischer Läsionen der Bauchspeicheldrüse erstreckt sich über viele Jahre und bei jeder Verlaufskontrolle sollen alle wichtigen Eigenschaften mit den Voruntersuchungen verglichen werden. Viele Patient:innen haben seit Jahren bekannte Pankreaszysten, die regelmäßig kontrolliert werden, und stellen sich erst nach morphologischen Veränderungen oder dem Auftreten verdächtiger Merkmale in einem zertifizierten „Pankreaskrebszentrum“ der Deutschen Krebsgesellschaft (DKG) vor. Die anamnestische Rekonstruktion und der Vergleich aller stattgefundenen Kontrollen sind häufig lückenhaft, wodurch die Zusammenarbeit mehrerer Spezialist:innen erschwert wird und es zu einem Informationsverlust kommen kann, der für die Behandlung der Patient:innen entscheidend ist, ja prognosebestimmend werden kann.
Um diesen Problemen entgegenzuwirken, haben wir ein individuelles und präzises medizinisches Dokument entwickelt: den „Pankreaszystenpass“. Dieser Pass ist sowohl in gedruckter Form als auch digital verfügbar, wodurch er auf Mobilgeräten jederzeit abrufbar ist und bei jeder medizinischen Untersuchung griffbereit verwendet werden kann (siehe Abb. 1).

Abb. 1: QR-Code zum Magdeburger Register für Pankreaszysten (MRPZ)
Der Pankreaszystenpass: Funktionsweise
Der Pass wird den Patient:innen als Druckvorlage ausgehändigt und darin der Verlauf der Zystenentwicklung dokumentiert. Der Pass bleibt wie eine Art Impfpass bei den Patient:innen. Bei Vorlage beim behandelnden Arzt kann dann die kontinuierliche Verlaufsdokumentation der Zysten dargestellt und erfasst werden. Durch einfaches Scannen eines QR-Codes wird die/der Patient:in auf die Internetseite ihres/seines persönlichen Zystenpasses geleitet. Im Universitätsklinikum Magdeburg A. ö. R. wird aktiv auf eine webbasierte Softwareanwendung, die gezielt entwickelt wurde, um Forschungsdaten zu sammeln, zu speichern und effektiv zu verwalten, zurückgegriffen. Dieser Pass kann von der/vom Patient:in selbst oder mit Unterstützung ihrer/s bzw. seiner/s behandelnden Ärztin/Arztes ausgefüllt werden und erfasst bei der Erstdiagnose sowie bei jeder Kontrolluntersuchung alle relevanten Informationen zu den Pankreaszysten, den Blutuntersuchungen und den diagnostischen Verfahren. Zusätzlich besteht die Möglichkeit, Fotos von schriftlichen Befunden (wie MRT oder EUS) hochzuladen.
Hierdurch wird ein präziser Überblick über alle vergangenen Untersuchungen ermöglicht und die Bereitstellung angemessener medizinischer Empfehlungen zur Behandlung der Zyste wird erleichtert. Die Zusammenarbeit und Kommunikation zwischen verschiedenen Spezialist:innen und der/m Hausärzt:in werden vereinfacht – daneben wird der Verlust wichtiger Informationen vermieden. Der Pankreaszystenpass ist ein Instrument, das Patient:innen und ÄrztInnen bessere Klarheit verschaffen möchte: Das Hauptziel besteht darin, die zystische Läsion korrekt zu interpretieren, die Behandlung zu optimieren und die psychologische Belastung der Patient:innen zu reduzieren.
Ein weiterer Nutzen des Passes besteht auch darin, dass durch das alleinige Ausfüllen des digitalen Pankreaszystenpasses alle Informationen automatisch in der Datenbank des hiesigen von der DKG zertifizierten Pankreaskarzinomzentrums gespeichert werden. Dadurch entsteht das „Magdeburger Register für Pankreaszysten“ (MRPZ), ein einzigartiges Instrument, das einen deutschlandweiten Überblick über diese Diagnose verschafft. Dies ermöglicht Forschungsprojekte, die das Wissen über Pankreaszysten verbessern und die medizinische Versorgung dieser Patient:innen optimieren können (Abb. 2 bis 4).
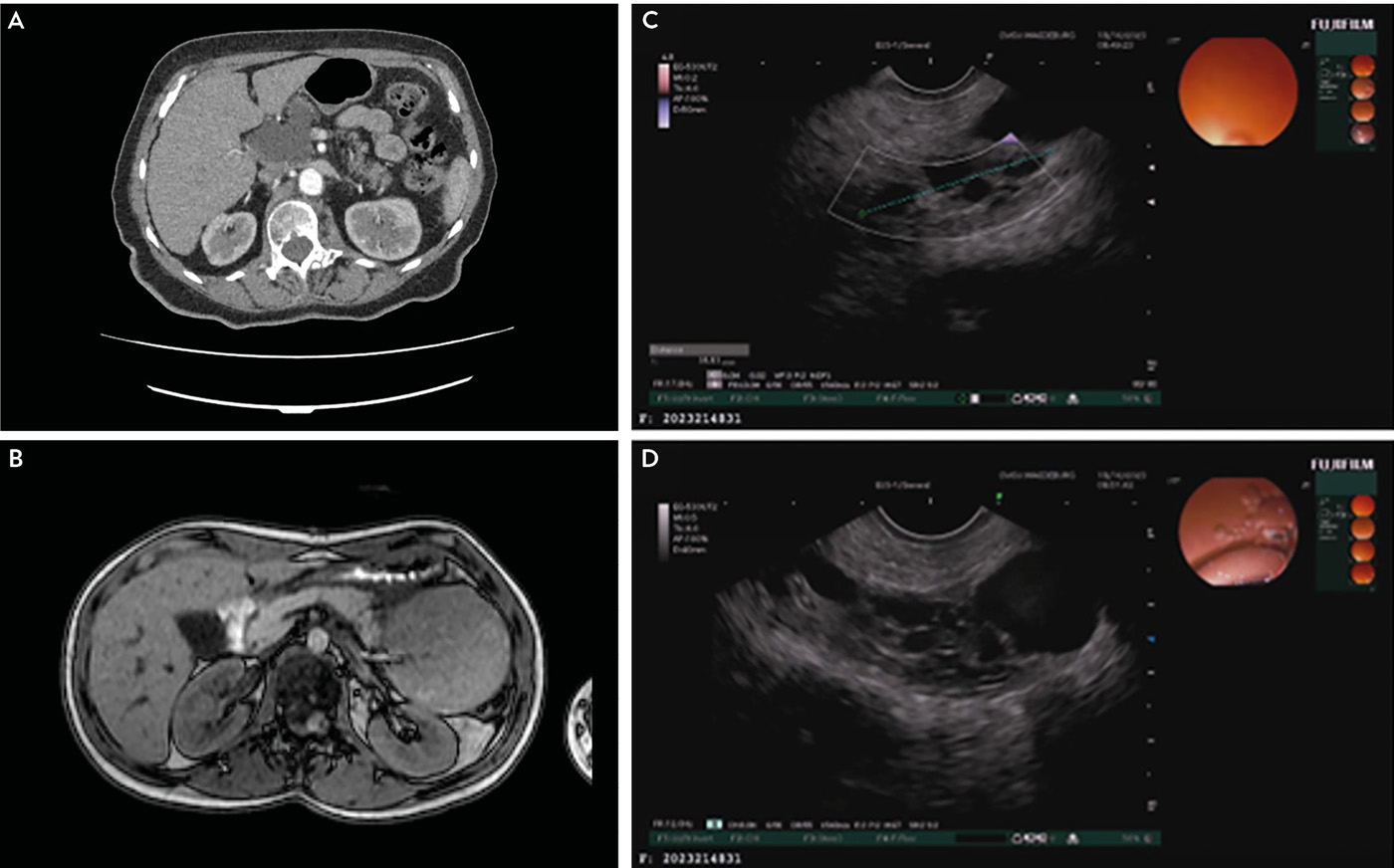
Abb. 2: Repräsentative Abbildungen zu Bildgebungsverfahren von zystischen Pankreasläsionen: A) CT-Scan eines serösen Zystadenoms des Pankreas, B) MRT-Scan einer Pankreas-assoziierten solid-pseudopapillären Neoplasie, C, D) EUS-“Image” einer intrapankreatischen muzinös-zystischen Neoplasie, oberes und unteres Panel repräsentieren verschiedene Schnittebenen.
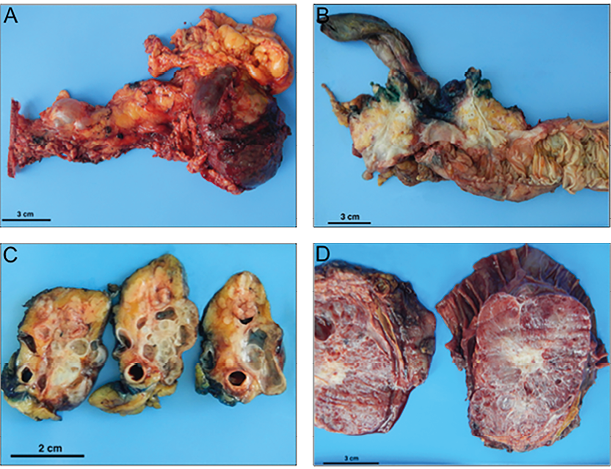
Abb. 3: Makroskopische Aspekte zystischer Pankreasraumforderungen: A) Distales Pankreasresektat mit Milz mit muzinöser zystischer Neoplasie, B) Resektat einer partiellen Duodenopankreatektomie mit Hauptgang-IPMN des Pankreaskopfes und assoziiertem Adenokarzinom, C) Schnittfläche einer IPMN ohne Karzinom, D) Pankreaskopfresektat mit serösem Zystadenom mit typischer Honigwabenstruktur und zentraler Narbe.
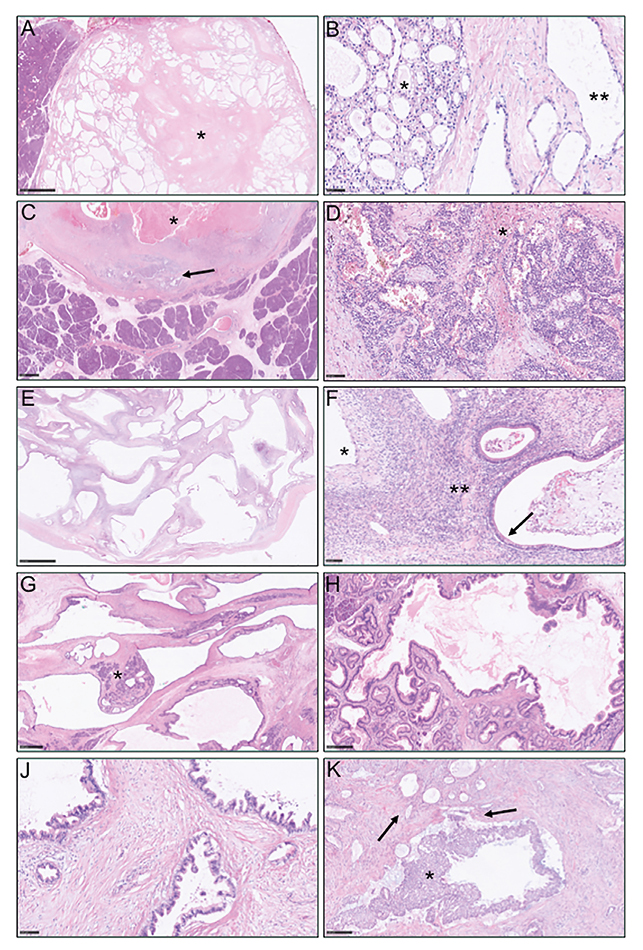
Abb. 4: Histomorphologische Aspekte zystischer Pankreasraumforderunge: A) Seröses Zystadenom mit zentraler Narbe (*) und B) Mikrozysten (*) sowie Makrozysten (**) mit atypiefreiem kubischen Epithel; C) Solide pseudopapilläre Neoplasie mit ausgedehntem zystisch-regressiven Tumoranteil (*) und randlich vitalen Tumorresten (->) sowie D) Schaumzellinfiltrate und Hämorrhagien (*) zwischen den Tumorinfiltraten; E) Muzinöse zystische Neoplasie mit weitlumigen, dickwandigen Zysten mit F) atypiefreiem, becherzellhaltigem (->) oder denudiertem Epithel (*) und ovarähnlichem Stroma (**); G) Intraduktale papillär-muzinöse Neoplasie mit Verdrängung und Atrophie des Pankreasparenchyms (*), H) Seitengang-IPMN vom gastralen Typ ohne Dysplasie, J) IPMN vom pankreatikobiliären Typ mit low grade intraepithelialer Neoplasie sowie K) mit high grade intraepithelialer Neoplasie des Hauptganges (*) und Übergang in ein assoziiertes Adenokarzinom (->) (15- bis 200fache Vergrößerung)
Fazit
Die Register-basierte systematische Erfassung, Auswertung und Interpretation von Pankreaszysten und assoziierten Daten stellt einen essentiellen und komplementären Studienansatz dar, um die Qualität der klinischen Alltagsbetreuung kompetent zu eruieren und Schlussfolgerungen für eine optimierte Versorgung abzuleiten. Der Magdeburger Pankreaszystenpass und das MRPZ sind eine in ihrer Art einzigartige deutschlandweite Initiative zur. Optimierung der Versorgungsforschung nicht maligner Pankreasläsionen und der frühzeitigen Erkennung einer malignen Transformation. Durch die Erkennung früher Stadien des Pankreaskarzinoms kann hierdurch eine Verbesserung der Prognose dieser Erkrankung erwartet werden.
Literatur
[1] Kromrey ML, Bülow R, Hübner J, Paperlein C, Lerch MM, Ittermann T, et al. Prospective study on the incidence, prevalence and 5-year pancreatic-related mortality of pancreatic cysts in a population-based study. Gut [Internet]. Gut; 2018 Jan 1 [cited 2023 Aug 16]; 67: 138–145.
[2] Schweber AB, Agarunov E, Brooks C, Hur C, Gonda TA. Prevalence, incidence, and risk of progression of asymptomatic pancreatic cysts in large sample real-world data. Pancreas. 2021; 50: 1287–1292.
[3] Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut [Internet]. BMJ Publishing Group; 2016 Feb 1 [cited 2023 Aug 21]; 65: 305–312.
[4] Del Chiaro M, Besselink MG, Scholten L, Bruno MJ, Cahen DL, Gress TM, et al. European evidence-based guidelines on pancreatic cystic neoplasms. Gut. BMJ Publishing Group; 2018. p. 789–804.
[5] Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO Classification of Tumours of the Digestive System. IARC Press; 2010.
[6] Robertis R De, Marchegiani G, Catania M, Ambrosetti MC, Capelli P, Salvia R. Solid Pseudopapillary Neoplasms of the Pancreas: Clinicopathologic and Radiologic Features According to Size. AJR Am J Roentgenol. 2019; 213(5): 1073–1080.
[7] Marchegiani G, Andrianello S, Massignani M, Malleo G, Maggino L, Paiella S, et al. Solid pseudopapillary tumors of the pancreas: Specific pathological features predict the likelihood of postoperative recurrence. J Surg Oncol. 2016; 114: 597–601.
[8] Sun G, Fang K, Fu X, Peng L, Shu J, Tu Y, et al. Solid Pseudopapillary Neoplasm of the Pancreas: A Multi-Institution Study of 118 Cases. Pancreas. 2023; 52: e121–e126.
[9] Marchegiani G, Andrianello S, Crippa S, Pollini T, Belfiori G, Gozzini L, et al. Actual malignancy risk of either operated or non-operated presumed mucinous cystic neoplasms of the pancreas under surveillance. Br J Surg [Internet]. Br J Surg. 2021 Sep 1 [cited 2023 Aug 22]; 108: 1097–1104.
[10] Marchegiani G, Mino-Kenudson M, Sahora K, Morales-Oyarvide V, Thayer S, Ferrone C, et al. IPMN Involving the Main Pancreatic Duct: Biology, Epidemiology, and Long-term Outcomes Following Resection. Ann Surg [Internet]. NIH Public Access; 2015 May 1 [cited 2023 Aug 22]; 261: 976.
[11] Tamura K, Ohtsuka T, Ideno N, Aso T, Shindo K, Aishima S, et al. Treatment strategy for main duct intraductal papillary mucinous neoplasms of the pancreas based on the assessment of recurrence in the remnant pancreas after resection: A retrospective review. Ann Surg [Internet]. 2014 Feb [cited 2023 Aug 22]; 259: 360–368.
[12] Balduzzi A, Marchegiani G, Pollini T, Biancotto M, Caravati A, Stigliani E, et al. Systematic review and meta-analysis of observational studies on BD-IPMNS progression to malignancy. Pancreatology. 2021 Sep 1; 21: 1135–1145.
[13] Tamburrino D, de Pretis N, Pérez-Cuadrado-Robles E, Uribarri-Gonzalez L, Ateeb Z, Belfiori G, et al. Identification of patients with branch-duct intraductal papillary mucinous neoplasm and very low risk of cancer: multicentre study. Br J Surg. 2022; 109: 617–622.
[14] Marchegiani G, Pollini T, Andrianello S, Tomasoni G, Biancotto M, Javed AA, et al. Progression vs Cyst Stability of Branch-Duct Intraductal Papillary Mucinous Neoplasms after Observation and Surgery. JAMA Surg. 2021; 156: 654–661.
[15] Crippa S, Bassi C, Salvia R, Malleo G, Marchegiani G, Rebours V, et al. Low progression of intraductal papillary mucinous neoplasms with worrisome features and high-risk stigmata undergoing non-operative management: A mid-term follow-up analysis. Gut. 2017; 66: 495–506.
[16] Pergolini I, Sahora K, Ferrone CR, Morales-Oyarvide V, Wolpin BM, Mucci LA, et al. Long-term Risk of Pancreatic Malignancy in Patients With Branch Duct Intraductal Papillary Mucinous Neoplasm in a Referral Center. Gastroenterology [Internet]. Gastroenterology; 2017 Nov 1 [cited 2023 Aug 22]; 153: 1284–1294.e1.
[17] Salvia R, Marchegiani G. Evolving management of pancreatic cystic neoplasms. Br J Surg. 2020; 107: 1393–1395.
[18] Luk L, Lowy AM, Li K, Fowler KJ, Wang ZJ, Kamel IR, et al. Pancreatic Cyst Surveillance: Who, Why, How? Radiology [Internet]. 2023 Jul 1 [cited 2023 Jul 27]; 308: e222 778.
[19] Rockacy M, Khalid A. Update on pancreatic cyst fluid analysis. Ann Gastroenterol [Internet]. 2013 [cited 2023 Aug 23]; 26: 122–127.
[20] Tjaden C, Sandini M, Mihaljevic AL, Kaiser J, Khristenko E, Mayer P, et al. Risk of the Watch-and-Wait Concept in Surgical Treatment of Intraductal Papillary Mucinous Neoplasm. JAMA Surg. 2021; 156: 818–825.
[21] Marinelli V, Secchettin E, Andrianello S, Moretti C, Donvito S, Marchegiani G, et al. Psychological distress in patients under surveillance for intraductal papillary mucinous neoplasms of the pancreas: The “Sword of Damocles” effect calls for an integrated medical and psychological approach a prospective analysis. Pancreatology. 2020 Apr 1; 20: 505–510.

Korrespondierende Autorin:
Dr. Sara Al-Madhi
Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie
Universitätsklinikum Magdeburg A. ö. R.
Leipziger Str. 44
39120 Magdeburg (Deutschland)
Chirurgie
Al-Madhi S, Acciuffi S, Meyer F, Dölling M, Wolniczak E, Jeong S, March C, Jechorek D, Andric M, Perrakis A, Croner RS: Magdeburger Pancreaszystenpass. Passion Chirurgie. 2024 November; 14(11): Artikel 03_02.
Mehr aus der Viszeralchirurgie finden Sie auf BDC|Online (www.bdc.de) unter der Rubrik Wissen | Fachgebiete | Viszeralchirurgie.
Weitere Artikel zum Thema
25.08.2022 Viszeralchirurgie
Zufriedenheit und Arbeits(zeit)gestaltung von Chirurg:innen in Deutschland – wo stehen wir aktuell?
Mittlerweile sind 14 Jahre vergangen, seitdem die Berufssituation der Chirurg:innen im Rahmen einer Umfrage des BDC zuletzt evaluiert und in der Passion Chirurgie 2009 veröffentlicht wurde [1]. Es ist nicht verwunderlich, dass sich in diesem Zeitraum sowohl die Chirurgie als auch die Rahmenbedingungen weiter verändert haben.
01.08.2022 BDC|News
Editorial 07/08-2022: UpDate Viszeralchirurgie
In der aktuellen Ausgabe der Passion Chirurgie werden in drei Artikeln die neuesten Entwicklungen bei der Behandlung von Krebserkrankungen des Rektums, der Leber und des Pankreas dargestellt. Neben den operativ-technischen Weiterentwicklungen haben sich vor allem auch die onkologischen Behandlungskonzepte bei den soliden viszeralen Tumoren in den letzten Jahren verändert.
01.08.2022 Viszeralchirurgie
Update Leberchirurgie
Die Leberchirurgie ist zentraler Eckpfeiler in der Therapie primärer Lebertumore und hepatisch metastasierter Tumorerkrankungen [1] – mit verbesserter medizinischer Evidenz und zunehmender Patientensicherheit erfolgt heute eine immer breitere Indikationsstellung zur Leberresektion. Dies basiert sowohl auf der Implementierung technischer Innovationen als auch der kontinuierlichen Verbesserung perioperativer Behandlungskonzepte.
01.08.2022 Viszeralchirurgie
Update Pankreaskarzinom
Als Pankreaskarzinom wird der mit circa 95 Prozent häufigste bösartige Tumor der Bauchspeicheldrüse bezeichnet, der histopathologisch korrekt als duktales Adenokarzinom des Pankreas (PDAC) beschrieben wird. Über die letzten Jahre wurden hier sowohl in der Systemtherapie als auch in der Chirurgie Fortschritte erzielt, sodass sich die Prognose insgesamt – vor allem bei resektablen Befunden – verbessern konnte.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.