01.10.2022 Viszeralchirurgie
Neue Therapiekonzepte in der endokrinen Chirurgie am Beispiel des anaplastischen Schilddrüsenkarzinoms

Einleitung
Das anaplastische Schilddrüsenkarzinom (ATC) ist mit einer Inzidenz von 1–2 Patienten pro Million Einwohner und Jahr das seltenste Schilddrüsenmalignom, stellt jedoch eine sehr aggressive Tumorentität mit einer Mortalität von bis zu 100 % dar (1). Verfügbare retrospektive Daten zeigen eine schlechte Prognose mit einem medianen Gesamtüberleben nach Erstdiagnose von 3–6 Monaten und einem medianen 1-Jahres-Überleben von etwa 20 % (1-3).
Im ATC-Stadium IVA und resektablen Stadium IVB ist die primäre Operation mit dem Ziel einer R0- oder R1-Resektion die Therapie der Wahl, häufig gefolgt von Bestrahlung in Kombination mit einer Chemotherapie oder im Rahmen klinischer Studien einer zielgerichteten Therapie je nach Tumorgenetik [1, 3]. Im initial nicht-resektablen Stadium IVB und im metastasierten Stadium IVC wird die frühzeitige Einleitung einer Chemotherapie mit Anthrazyklinen, Taxanen und Platin vorgeschlagen. Diverse experimentelle Arbeiten haben gezeigt, dass ATC ein bestimmtes Mutationsprofil aufweisen und daher ATC-Zellen auf eine zielgerichtete Therapie ansprechen können (64-6). Diese zielgerichtete Therapie wurde bisher vor allem in der palliativen Situation oder auch adjuvant nach Resektion eingesetzt [1, 7, 8].
Basierend auf diesen experimentellen Ergebnissen und ersten klinischen Erfahrungen kam die Idee auf, eine zielgerichtete, mutationsbasierte Therapie neoadjuvant beim ATC im Stadium IVB oder C anzuwenden, um eine Resektion des Primärtumors und ggf. seiner Metastasen zu erreichen. Einzelne kleine Fallserien unterstützen diese Hypothese [9–11]. Unsere hier vorgestellten Ergebnisse wie die anderer Gruppen [9–11] zeigen, dass eine „neoadjuvante“ BRAF-gerichtete Therapie bzw. im Fall eines nicht-BRAF-mutierten ATC einer mKI/Checkpoint-Inhibitor-Kombination eine Resektion des Tumors bei initial lokal fortgeschrittenem ATC ermöglichen kann, damit die lokale Tumorkontrolle optimiert und möglicherweise auch Überleben verlängert.
Nachfolgend berichten wir über die Ergebnisse einer erfolgreichen zeitlich begrenzten, mutationsbasierten, off-label, neoadjuvanten Behandlung bei drei ATC-Patienten im Stadium IVB und C.
Methodik
Bei klinischem Verdacht auf das Vorliegen eines ATC ist die erste diagnostische Maßnahme an unserer Klinik eine Stanzbiopsie, um so schnell wie möglich mit der Immunhistochemie (IHC) und der molekulargenetischen Analyse zu beginnen. Die zytologische Diagnose eines ATC durch Feinnadelaspirationzytologie kann schwierig sein [12]. Es werden schilddrüsenspezifische Proteine wie Thyreoglobulin (Tg) und der Schilddrüsen-Transkriptionsfaktor 1 (TTF-1) bestimmt. Im Allgemeinen fehlen sie beim ATC, was die undifferenzierte Natur des Tumors widerspiegelt. PAX-8-Expression wird bestimmt zur Differenzierung von undifferenzierten Sarkomen oder Plattenepithelkarzinomen. Die Zellproliferation wird durch Ki-67 bewertet. Der Verlust der p53-Tumorsuppressorfunktion durch somatische Mutation von TP53 wird als typisch für ein ATC und zur Abgrenzung zum schlecht differenzierten Schilddrüsenkarzinom (PDTC) gewertet. Der BRAF-Mutationsstatus wird ebenso wie die Mutation in Genen der RAS-Familie durch Molekularanalyse bestimmt. Die PD-L1-Expression wird gemessen, um die Möglichkeit einer Checkpoint-Inhibition zu klären.
Parallel werden bildgebende Verfahren durchgeführt. Das radiologische Tumorstaging erfolgt mittels MRT des Halses zur Beurteilung der lokalen Situation und einem 18F-FDG-PET/CT zum Nachweis bzw. Ausschluss einer Fernmetastasierung. Ösophagoskopie und Tracheoskopie werden durchgeführt, um ein potenzielles intraluminales Tumorwachstum zu nachzuweisen. Eine präoperative Laryngoskopie beurteilt die Stimmbandbeweglichkeit.
Sobald die Ergebnisse der Immunhistochemie und der Mutationsanalysen vorliegen, werden alle Patienten mit ATC in einer interdisziplinären Tumorkonferenz mit Fokus auf den klinischen Zustand und Komorbiditäten besprochen. Die Patienten werden ausführlich im interdisziplinären Tumorboard diskutiert und bei bisher drei Patienten die Entscheidung zur „neoadjuvanten“ zielgerichteten Therapie im Konsens getroffen. Die Patienten wurden anschließend über dies Möglichkeit dieser zulassungsüberschreitenden Therapie aufgeklärt und deren schriftliche Zustimmung eingeholt. Bei Vorliegen eines BRAF-mutierten ATC wurde eine Kombinationstherapie aus dem BRAF-Inhibitor Dabrafenib und dem MEK-Inhibitor Trametinib gewählt, bei einem BRAF-Wildtyp ATC eine Kombination aus dem PD-L1-Inhibitor Pembrolizumab und Multikinaseinhibitor Lenvatinib. Lenvatinib ist seit 2015 in Europa (EMA European Medicines Agency) für mehrere Tumorentitäten zugelassen, darunter die Therapie des differenzierten jodrefraktären Schilddrüsenkarzinoms. Die Checkpoint-Inhibitor-Therapie mit Pembrolizumab und die BRAF/MEK-Inhibitor-Therapie mit Dabrafenib und Trametinib sind in Europa derzeit noch nicht zur Therapie des ATC zugelassen. Bei der jeweiligen Krankenkasse wurde eine individuelle Genehmigung für die Therapie beantragt, die in allen drei beschriebenen Fällen genehmigt wurde. Eine antiangiogenetische Therapie mit Lenvatinib 20mg täglich als bridging wurde sofort begonnen und nach entsprechender Genehmigung mit Pembrolizumab kombiniert (200 mg alle drei Wochen) oder bei Nachweis einer BRAF-Mutation auf Trametinib 4mg täglich/Dabrafenib 150 mg zweimal täglich umgestellt. Diese individuelle, mutationsbasierte Therapie wurde über vier Wochen fortgeführt.
Nach diesem begrenzten Zeitraum von vier Wochen erfolgte ein Re-Staging mittels 18F-FDG-PET/CT. Bei signifikantem Therapieansprechen mit Größenabnahme des Primärtumors um >50 % wurde die chirurgische Resektion erneut diskutiert. Diese kurze Dauer der „neoadjuvanten“ Behandlung wurde gewählt, um das Risiko von Arrosionsblutungen und/oder Fistelbildung durch die rasche lokale Tumorschrumpfung zu reduzieren [13, 14]. Es wurde dann zunächst eine Primärtumorresektion mittels Thyreoidektomie und Lymphadenektomie durchgeführt. In einem zweiten Schritt wurden ggf. limitierte Fernmetastasen etwa vier Wochen nach der Thyreoidektomie reseziert. Nach einer postoperativen Erholung von etwa zwei Wochen wurde die gezielte systemische Therapie fortgesetzt.
Ergebnisse
Zwischen Dezember 2021 und Mai 2022 wurden drei Patienten (Alter 57, 73, 81 Jahre) im Stadium IVB (1 Patient) und IVC (zwei Patienten) mit einer mutationsbasierten, vierwöchigen „neoadjuvanten“ Therapie gefolgt von einer Tumorresektion behandelt (siehe Tab. 1).
Tab. 1: Charakteristika der ATC-Patienten mit „neoadjuvanter“ zielgerichteter Therapie
|
Patient |
Geschlecht w/m |
Alter (Jahre) |
UICC Stadium |
„Neoadjuvante“ Therapie (4-6 Wochen) |
Operative Therapie |
TNM-Stadium |
Postoperative Therapie |
|
#1 |
w |
81 |
IVC (1 Lungenmetastase) |
Lenvatinib |
1. Thyreoidektomie mit zentraler/latraler LA, Resektion der thrombosierten V. jugularis interna, Resektion N. recurrens 2. Lungemetastasenresektion rechts |
ypT4a, ypN1b, L0 V0 Pn1 R1 (Trachea) ypM1 (pulmo), R0 |
Lenvatinib plus Pembrolizumab |
|
#2 |
m |
57 |
IVC (multiple kleine Lungenmetastasen) |
Lenvatinib plus Pembrolizimab |
Thyreoidektomie mit zentraler/linkslateraler LA, Resektion der thrombosierten V. jugularis interna |
ypT4a ypN0, L0 V1 Pn0 R0 |
Lenvatinib plus Pembrolizimab |
|
#3 |
m |
73 |
IVB (Trachealeinbruch) |
Dabrafenib plus Trametinib |
Thyreoidektomie mit zentraler LA bds |
ypT3b, ypN0 L0 V1 Pn1 R0 |
Dabrafenib plus Trametinib |
LA: Lymphadenektomie
Bei zwei Patienten wurde ein ATC im Stadium IVC (pulmonale Metastasen) diagnostiziert, bei einem Patienten lag das Stadium IVB mit Infilrtation der Trachea vor. Die Stanzbiopsie ergab in zwei Fällen ein BRAF-wildtyp-ATC mit einer PD-L1-Expression von 80 % bzw. 90 % (TPS-Score). Einer der beiden Patienten erhielt eine „neoadjuvante“ Therapie mit Lenvatinib und Pembrolizumab. Eine Patientin wurde lediglich Lenvatinib vorbehandelt wegen langer Wartezeit auf die Genehmigung der Krankenkasse für den Einsatz von Pembrolizumab, das erst postoperativ verabreicht wurde. Bei dem dritten Patienten wurde eine BRAF-Mutation nachgewiesen, hier erfolgte die „neoadjuvante“ Therapie mit Dabrafenib und Trametinib.
Bei allen drei Patienten war ein deutliches Therapieansprechen zu verzeichnen, das Re-Staging zeigte jeweils einen beeindruckenden Größenregress und verminderte FDG-Aufnahme (Abb. 1). Bei einem Patienten waren die kleine Lungenmetastasen nicht mehr nachweisbar. Bei allen drei Patienten erfolgte eine Thyreoidektomie und Lymphadenektomie, es wurden bei zwei Patienten eine R0 und bei einem Patienten eine R1 (Trachealinfiltration) erreicht. In einem Fall wurde nach Rekonvaleszenz vier Wochen nach der Schilddrüsenoperation eine singuläre Lungenmetastase reseziert. Es traten keine postoperativen Komplikationen auf, die Patienten wurden nach 5-7 Tagen entlassen. Die individuelle zielgerichtete Therapie wurde nach Abschluss der Wundheilung fortgesetzt. Bei der ersten Nachsorgeuntersuchung drei Monate postoperativ mittels FGD-PET/CT gab es bei keinem der drei Patienten den Nachweis eines Rezidivs oder von Metastasen.
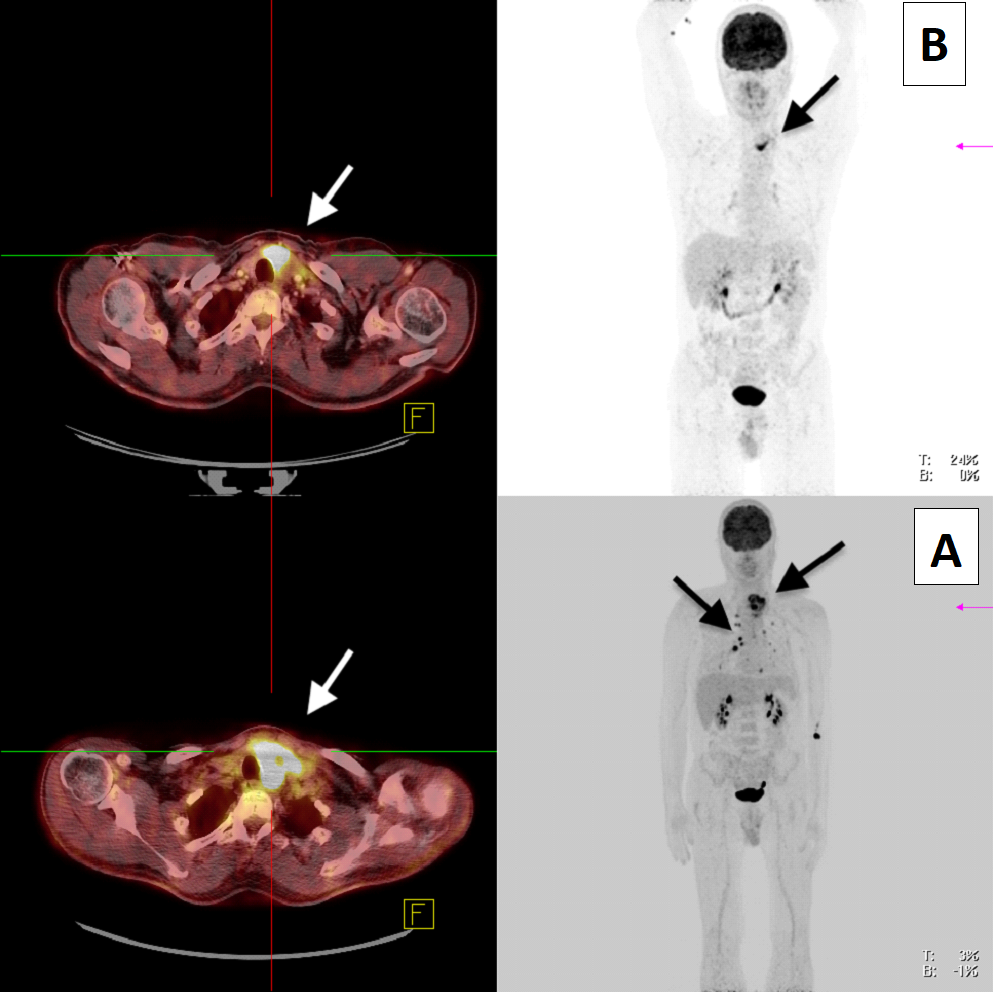
Abb. 1: Patient #2: 18F-FDG-PET/CT vor (A) und nach (B) „neoadjuvanter“ zielgerichteter Therapie. Regredienter Primärtumor im Bereich der linken Schilddrüsenloge (Pfeil) und nicht mehr nachweisbare pulmonale Filiae nach neoadjuvanter Therapie.
Diskussion
In allen drei Fällen induzierte die kurzzeitige „neoadjuvante“ Therapie ein beeindruckendes Ansprechen und führte zu lokaler Resektabilität bei primär nicht-resektablen ATC im Stadium IVB oder C. Die komplette Tumorresektion verbessert nachweislich die Prognose des ATC [1, 3, 15, 16]. Da sich die meisten Patienten – wie auch unsere – mit einer lokal inoperablen Erkrankung aufgrund einer lokalen Infiltration von A. carotis, Larynx, Trachea oder Ösophagus vorstellen, ist die Möglichkeit mit einer „neoadjuvanten“ Therapie eine Resektabilität zu erreichen von großer Bedeutung.
Die Option, eine BRAF-mutationsbasierte „neoadjuvante“ Therapie anzuwenden, hat in mehreren kleinen Fallserien Erfolge bezüglich der lokalen Resektabilität gezeigt [9–11]. Somatische Mutationen von BRAF bestehen in 40–70 % der ATC, 11–28 % der ATC exprimieren PD-L1 [17].
Wir haben zum ersten Mal eine kurzzeitige „neoadjuvante“ Behandlungsperiode gewählt, um das Risiko von Arrossionsblutungen und/oder Fisteln aufgrund einer möglichen schnellen Tumorschrumpfung zu reduzieren [13, 14]. Das Re-Staging mit einem 18F-FDG-PET/CT nach 4- bis 6-wöchiger „neoadjuvanter“ Behandlung konnte bei allen drei Patienten eine signifikante Tumorreduktion wie auch die komplette Remission von kleinen Lungenmetastasen bei reduzierter Glukoseaufnahme nachweisen. Dies weist darauf hin, dass eine kurze neoadjuvante Behandlungsdauer ausreichen könnte, um eine Resektabilität zu erreichen. Wang et al. berichteten über den Verlauf von sechs Patienten mit BRAF-mutiertem, lokal fortgeschrittenem ATC. Die mediane Dauer der „neoadjuvanten“ Behandlung betrug vier Monate [10]). Nach diesem Zeitraum wurden alle Patienten operiert und es konnte viermal eine R0-Resektion und zweimal eine R1-Resektion erreicht werden. Unsere Operationsergebnisse nach nur vierwöchiger „neoadjuvanter“ Therapie waren mit zwei R0- und einer R1-Resektion ähnlich. McCrary et al. beschrieben ebenfalls eine neoadjuvante Behandlung bei vier Patienten mit ATC, zwei mit BRAF-mutiertem Tumor und zwei mit BRAF-wildtyp Tumoren. Bisher wurde ein Patient nach vier Monaten Therapie mit Dabrafenib und Trametinib operiert. Im postoperativen histopathologischen Bericht wurde das Stadium ypT1ypN0 angegeben [11].
Die postoperative histopathologische Befunde zeigten bestätigten bei unseren drei Patienten ein Ausmaß an Tumornekrose oder regressivem fibrotischem Gewebe zwischen 60 und > 95 %. Der Fallbericht des MD Anderson Cancer Center zeigte 30 % Nekrose nach „neoadjuvanter“ Behandlung mit Dabrafenib-Monotherapie und im Verlauf zusätzlich Pembrolizumab für drei Monate [9]. Dies impliziert, dass eine kurze neoadjuvante Behandlungsdauer für eine Tumorregression ausreicht.
Es ist derzeit unklar, ob die Fortführung der Therapie mit BRAF/MEK-Inhibitoren oder eine Immuntherapie in Kombination mit mKI postoperativ ausreicht, um ein Lokalrezidiv oder eine Fernmetastasierung zu vermeiden. Eine zusätzliche postoperative (Chemo-)Strahlentherapie könnte erwogen werden, wurde aber bei unseren Patienten bisher nicht durchgeführt. Wir entschieden uns, die Behandlung mit BRAF/MEK-Inhibitoren fortzusetzen.
Während wir auf die Genehmigung zum „off-label-use“ des PD-L1-Inhibitors oder BARF/MEK-Inhibitoren warteten, wurden unsere Patienten „nur“ mit mKI behandelt. Ein zusätzliches bridging mit einer Chemotherapie (zum Beispiel Carboplatin und Paclitaxel) könnte sinnvoll sein.
Zusammenfassend kann eine 4- bis 6-wöchige mutationsbasierte „neoadjuvante“ Therapie die Resektabilität beim initial inoperablen ATC-Stadium IVB oder C ermöglichen, ohne dass während des kurzen Behandlungsintervalls lebensbedrohliche Komplikationen wie Arrosionsblutungen oder Fisteln auftraten. Die Langzeitprognose bleibt abzuwarten. Der Einsatz dieser in Deutschland noch nicht für das ATC zugelassen zielgerichteten Substanzen und die Verfügbarkeit einer schnellen und umfangreichen molekulargenetischen Analyse macht derartige Konzepte schwierig umsetzbar und erfordert die Infrastruktur einer Universitätsklinik. Basierend auf diesen ermutigenden ersten Ergebnissen wird derzeit eine prospektive AMG-Beobachtungsstudie vorbereitet.
Literatur
[1] Bible KC, Kebebew E, Brierley J, Brito JP, Cabanillas ME, Clark TJ Jr, Di Cristofano A, Foote R, Giordano T, Kasperbauer J, Newbold K, Nikiforov YE, Randolph G, Rosenthal MS, Sawka AM, Shah M, Shaha A, Smallridge R, Wong-Clark CK. 2021 American Thyroid Association Guidelines for Management of Patients with Anaplastic Thyroid Cancer. Thyroid. 2021 Mar;31(3):337-386.
[2] Haddad RI, Lydiatt WM, Ball DW, Busaidy NL, Byrd D, Callender G, Dickson P, Duh QY, Ehya H, Haymart M, Hoh C, Hunt JP, Iagaru A, Kandeel F, Kopp P, Lamonica DM, McCaffrey JC, Moley JF, Parks L, Raeburn CD, Ridge JA, Ringel MD, Scheri RP, Shah JP, Smallridge RC, Sturgeon C, Wang TN, Wirth LJ, Hoffmann KG, Hughes M. Anaplastic Thyroid Carcinoma, Version 2.2015. J Natl Compr Canc Netw. 2015 Sep;13(9):1140-50.
[3] Wächter S, Vorländer C, Schabram J, Mintziras I, Fülber I, Manoharan J, Holzer K, Bartsch DK, Maurer E. Anaplastic thyroid carcinoma: changing trends of treatment strategies and associated overall survival. Eur Arch Otorhinolaryngol. 2020 May;277(5):1507-1514.
[4] Wächter S, Wunderlich A, Roth S, Mintziras I, Maurer E, Hoffmann S, Verburg FA, Fellinger SA, Holzer K, Bartsch DK, Di Fazio P. Individualised Multimodal Treatment Strategies for Anaplastic and Poorly Differentiated Thyroid Cancer. J Clin Med. 2018 May 15;7(5):115.
[5] Wächter S, Di Fazio P, Maurer E, Manoharan J, Keber C, Pfestroff A, Librizzi D, Bartsch DK, Luster M, Eilsberger F. Prostate-Specific Membrane Antigen in Anaplastic and Poorly Differentiated Thyroid Cancer-A New Diagnostic and Therapeutic Target? Cancers (Basel). 2021 Nov 14;13(22):5688.
[6] Wächter S, Knauff F, Roth S, Holzer K, Maurer E, Bartsch DK, Di Fazio P. Synergic induction of autophagic cell death in anaplastic thyroid cancer. Cancer Invest, under review.
[7] Dierks C, Seufert J, Aumann K, Ruf J, Klein C, Kiefer S, Rassner M, Boerries M, Zielke A, la Rosee P, Meyer PT, Kroiss M, Weißenberger C, Schumacher T, Metzger P, Weiss H, Smaxwil C, Laubner K, Duyster J, von Bubnoff N, Miething C, Thomusch O. Combination of Lenvatinib and Pembrolizumab Is an Effective Treatment Option for Anaplastic and Poorly Differentiated Thyroid Carcinoma. Thyroid. 2021 Jul;31(7):1076-1085.
[8] Maniakas A, Dadu R, Busaidy NL, Wang JR, Ferrarotto R, Lu C, Williams MD, Gunn GB, Hofmann MC, Cote G, Sperling J, Gross ND, Sturgis EM, Goepfert RP, Lai SY, Cabanillas ME, Zafereo M. Evaluation of Overall Survival in Patients With Anaplastic Thyroid Carcinoma, 2000-2019. JAMA Oncol. 2020 Sep 1;6(9):1397-1404.
[9] Cabanillas ME, Ferrarotto R, Garden AS, Ahmed S, Busaidy NL, Dadu R, Williams MD, Skinner H, Gunn GB, Grosu H, Iyer P, Hofmann MC, Zafereo M. Neoadjuvant BRAF- and Immune-Directed Therapy for Anaplastic Thyroid Carcinoma. Thyroid. 2018 Jul;28(7):945-951.
[10] Wang JR, Zafereo ME, Dadu R, Ferrarotto R, Busaidy NL, Lu C, Ahmed S, Gule-Monroe MK, Williams MD, Sturgis EM, Goepfert RP, Gross ND, Lai SY, Gunn GB, Phan J, Rosenthal DI, Fuller CD, Morrison WH, Iyer P, Cabanillas ME. Complete Surgical Resection Following Neoadjuvant Dabrafenib Plus Trametinib in BRAFV600E -Mutated Anaplastic Thyroid Carcinoma. Thyroid. 2019 Aug;29(8):1036-1043.
[11] McCrary HC, Aoki J, Huang Y, Chadwick B, Kerrigan K, Witt B, Hunt JP, Abraham D. Mutation based approaches to the treatment of anaplastic thyroid cancer. Clin Endocrinol (Oxf). 2022 May;96(5):734-742.
[12] Giard RW, Hermans J. Use and accuracy of fine-needle aspiration cytology in histologically proven thyroid carcinoma: an audit using a national pathology database. Cancer. 2000 Dec 25;90(6):330-4.
[13] Obata K, Sugitani I, Ebina A, Sugiura Y, Toda K, Takahashi S, Kawabata K. Common carotid artery rupture during treatment with lenvatinib for anaplastic thyroid cancer. Int Cancer Conf J. 2016 Jul 27;5(4):197-201.
[14] Staub Y, Nishiyama A, Suga Y, Fujita M, Matsushita R, Yano S. Clinical Characteristics Associated With Lenvatinib-induced Fistula and Tumor-related Bleeding in Patients With Thyroid Cancer. Anticancer Res. 2019 Jul;39(7):3871-3878.
[15] Pierie JP, Muzikansky A, Gaz RD, Faquin WC, Ott MJ. The effect of surgery and radiotherapy on outcome of anaplastic thyroid carcinoma. Ann Surg Oncol. 2002 Jan-Feb;9(1):57-64.
[16] Wendler J, Kroiss M, Gast K, Kreissl MC, Allelein S, Lichtenauer U, Blaser R, Spitzweg C, Fassnacht M, Schott M, Führer D, Tiedje V. Clinical presentation, treatment and outcome of anaplastic thyroid carcinoma: results of a multicenter study in Germany. Eur J Endocrinol. 2016 Dec;175(6):521-529.
[17] Deeken-Draisey A, Yang GY, Gao J, Alexei BA. Anaplastic thyroid carcinoma: an epidemiologic, histologic, immunohistochemical, and molecular single-institution study. Hum Pathol. 2018 Dec;82:140-148.

Korrespondierender Autor:
Prof. Dr. med. Detlef K. Bartsch
Direktor
Klinik für Visceral-, Thorax- und Gefäßchirurgie
Universitätsklinikum Gießen und Marburg GmbH
Standort Marburg
E. Maurer
Klinik für Visceral-, Thorax- und Gefäßchirurgie
F. Eilsberger
Klinik für Nuklearmedizin
S. Wächter
Klinik für Visceral-, Thorax- und Gefäßchirurgie
J. Riera Knorrenschild
Klinik für Hämatologie, Onkologie und Immunologie
A. Pehl
Institut für Pathologie, Universitätsklinkum Gießen und Marburg GmbH, Standort Marburg
K. Holzer
Klinik für Visceral-, Thorax- und Gefäßchirurgie
A. Neubauer
Klinik für Hämatologie, Onkologie und Immunologie
M. Luster
Klinik für Nuklearmedizin
Chirurgie
Neue Therapiekonzepte in der endokrinen Chirurgie am Beispiel des anaplastischen Schilddrüsenkarzinoms. Passion Chirurgie. 2020 Oktober; 12(10): Artikel 03_02.
Diesen Artikel finden Sie auf BDC|Online (www.bdc.de) unter der Rubrik Wissen | Fachgebiete | Viszeralchirurgie.
Weitere aktuelle Artikel
01.08.2022 Viszeralchirurgie
Update Leberchirurgie
Die Leberchirurgie ist zentraler Eckpfeiler in der Therapie primärer Lebertumore und hepatisch metastasierter Tumorerkrankungen [1] – mit verbesserter medizinischer Evidenz und zunehmender Patientensicherheit erfolgt heute eine immer breitere Indikationsstellung zur Leberresektion. Dies basiert sowohl auf der Implementierung technischer Innovationen als auch der kontinuierlichen Verbesserung perioperativer Behandlungskonzepte.
01.08.2022 Viszeralchirurgie
Update Pankreaskarzinom
Als Pankreaskarzinom wird der mit circa 95 Prozent häufigste bösartige Tumor der Bauchspeicheldrüse bezeichnet, der histopathologisch korrekt als duktales Adenokarzinom des Pankreas (PDAC) beschrieben wird. Über die letzten Jahre wurden hier sowohl in der Systemtherapie als auch in der Chirurgie Fortschritte erzielt, sodass sich die Prognose insgesamt – vor allem bei resektablen Befunden – verbessern konnte.
01.08.2022 Viszeralchirurgie
Hygiene-Tipp: Intraoperativer Ultraschall
Teilweise wird heute intraoperativ Ultraschall eingesetzt, z. B. am Hirn oder an der Leber. In der Praxis ist dabei meistens der Ultraschallkopf mit einer sterilen Hülle überzogen. Diese Situation ist unbefriedigend, da die Aufbereitung des Ultraschallkopfes allenfalls desinfizierend – und nicht sterilisierend – möglich ist und somit durch Mikrolöcher der Hülle oder Kontamination der Hülle außen beim Aufziehen eine sichere Sterilität beim Einsatz nicht gewährleistet ist.
01.08.2022 Viszeralchirurgie
Update Rektumkarzinom
Die Therapie des Rektumkarzinoms hat in den vergangenen Jahren ein hohes Maß an Innovation erfahren. Dies betrifft jedoch nicht nur die Evolution der OP-Strategien und Techniken, sondern insbesondere den Zuwachs an Erfahrung und Neuentwicklungen im Bereich der multimodalen Behandlung durch Bestrahlung und tumorgerichtete medikamentöse Therapie.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.