01.04.2021 Mund-, Kiefer- & Gesichtschirurgie
Diagnostik und Therapie von Gefäßanomalien im Kopf- und Halsbereich

In der gängigen Klassifikation der ISSVA (International Society for the Study of Vascular Anomalies) wird prinzipiell zwischen vaskulären Tumoren und vaskulären Malformationen unterschieden. Während vaskuläre Tumore echte proliferative Erkrankungen darstellen, handelt es sich bei Malformationen um angeborene Gefäßfehlbildungen mit fehlerhafter, dysplastischer Gefäßreifung. Aufgrund der Seltenheit von vaskulären Anomalien sowie der unsachgemäßen Verwendung verschiedener Begrifflichkeiten kommt es nicht selten zu Fehldiagnosen und infolgedessen dann auch zu fehlerhaften Behandlungsansätzen oder Prognoseeinschätzungen [1, 2].
Der hier beschriebene Diagnostik- und Therapiealgorithmus orientiert sich mit Ausnahme der Hämangiome an den vaskulären Fehlbildungen, welche den Hauptanteil der vaskulären Anomalien darstellen und denen sowohl diagnostisch wie auch therapeutisch die größte Bedeutung zukommt. Für die Diagnostik und Therapie vaskulärer Fehlbildungen hat sich ein interdisziplinäres Vorgehen bewährt.
Unterteilung und Klassifikation
Bei vaskulären Malformationen handelt es sich um angeborene Gefäßfehlbildungen, die proportional zum Körperwachstum an Größe zunehmen und dadurch oft erst im Verlauf symptomatisch werden [3]. Eine spontane Größenzunahme ist auch unter Stress, nach mechanischem Trauma oder bei hormonellen Veränderungen (z. B. Schwangerschaft, Pubertät) möglich [1]. Anhand der hämodynamischen Eigenschaften unterscheidet man zwischen sogenannten Low-Flow- und High-Flow-Malformationen. Innerhalb der Gruppe der Low-Flow-Malformationen unterscheidet man zwischen venösen, lymphatischen und kapillären Malformationen.
Bei der venösen Malformation handelt es sich mit ca. 60–70% um die häufigste Low-Flow-Malformation mit überwiegender Lokalisation im Kopf-Hals-Bereich (60%), gefolgt von den Extremitäten und dem Rumpf. Venöse Malformationen können multifokal kutan, subkutan, intramuskulär, intraossär oder in Organen vorkommen [4].
Die lymphatische Malformation ist die zweithäufigste Low-Flow-Malformation (12%), mit einer Häufigkeit von ca. 70% im Kopf-Hals-Bereich lokalisiert [4]. Man unterscheidet zwischen makrozystischen, mikrozystischen und gemischten Formen, wobei mikrozystische lymphatische Malformationen ein infiltratives Wachstumsmuster zeigen und somit schwierig zum umgebenden Gewebe abgrenzbar sind. Lymphatische Malformationen können multifokal kutan, subkutan, viszeral und intraossär vorkommen [5, 6].
Bei den kapillären Malformationen handelt es sich um eine krankhafte Erweiterung der Kapillaren. Mit einer Inzidenz von 0,3% sei als wichtigster Vertreter der Naevus flammeus (auch Feuermal oder Portweinfleck) genannt, welcher auch im Rahmen syndromaler Erkrankungen (Klippel-Trenaunay-Syndrom, Sturge-Weber-Syndrom) auftritt und am häufigsten im Kopf-Halsbereich zu finden ist. Im Weiteren gehört auch der sogenannte Naevus simplex (Storchenbiss) zu den kapillären Malformationen, der bei ca. 40% aller Neugeborenen zu finden ist [7].
Bei den High-Flow-Malformation unterscheidet man zwischen den arteriovenösen Fisteln (AVF) und arteriovenösen Malformationen (AVM). Während bei den arteriovenösen Fisteln ein direkter arteriovenöser Übergang („Shunt“) besteht, ist bei den arteriovenösen Malformationen ein System aus dysplastischen Gefäßen („Nidus“) zwischengeschaltet. Zur klinischen Stadieneinteilung und Evaluation des Therapiebedarfs wie auch der Therapiemöglichkeiten hat sich für arteriovenöse Malformationen die Schobinger-Klassifikation etabliert, welche 4 Entwicklungsstadien beschreibt:
- Ruhephase weitgehend ohne Symptome,
- Expansionsphase mit Schwellungszunahme und Pulsation,
- destruktive Phase mit Ulzerationen und Blutungen und
- Dekompensationsphase mit Herzinsuffizienz und Herzversagen.
Im Gegensatz zu AV-Malformationen können AV-Fisteln auch erworben sein (u. a. durch Traumata oder iatrogen bei Punktionen) [8].
Wichtigster Vertreter der vaskulären Tumore ist das Hämangiom, wobei ein infantiles von einem kongenitalen unterschieden wird. Das infantile Hämangiom ist mit einer Inzidenz von 3–10% der häufigste Tumor im Kleinkindalter, welcher sich in den ersten Wochen nach Geburt manifestiert und sich durch ein typisches Wachstumsverhalten (Proliferations-, Ruhe- und Involutionphase) auszeichnet. 40–60% der infantilen Hämangiome treten im Kopf- und Halsbereich auf und werden je nach Infiltrationstiefe in superfizielle (intrakutane), gemischte und tiefe (subkutane) Hämangiome eingeteilt. Davon abzugrenzen sind die kongenitalen Hämangiome, die bei Geburt bereits vollständig ausgereift sind. Hierbei wird zwischen den RICH („rapidly-involuting haemangioma“) mit Rückbildungstendenz und den NICH („non-involuting haemangioma“) ohne Rückbildungstendenz unterschieden [7, 9].
Klinische Diagnostik
Im Rahmen der Diagnosestellung spielt neben einer sorgfältigen Anamnese die klinische Untersuchung eine wegweisende Rolle.
Kapilläre Malformationen sind gekennzeichnet durch von Geburt an bestehende, meist einseitige und scharf begrenzte, erythematöse, homogene und im Hautniveau gelegene Veränderungen. Der Naevus simplex imponiert mittig, meist im Bereich des Hinterkopfes oder der Stirn, als unscharf begrenzte, blassrote und symmetrische Veränderung [7].
Venöse Malformationen zeigen klinisch eine weiche und leicht komprimierbare Schwellung, je nach Tiefe der Lokalisation mit darüberliegendem, livide imponierendem und teils nodulär tastbarem Hautanteil. Bei Erhöhung des venösen Drucks (Veränderung der Körperposition, bei körperlicher Belastung, bei Valsalva-Manöver) kommt es typischerweise zu einer (schmerzhaften) Schwellungszunahme, die bei streng subkutan gelegenen Veränderungen die Malformation klinisch erst sichtbar macht. Aufgrund des reduzierten Blutflusses kann es innerhalb venöser Malformationen im Intervall zu schmerzhaften, von einer lokalen Entzündungsreaktion begleiteten, und im Verlauf selbstlimitierenden Thrombosen (Thrombophlebitiden) kommen [7, 8].
Lymphatische Malformationen zeigen sich klinisch ebenfalls als weiche, komprimierbare Schwellungen. Die darüberliegende Haut kann normal oder bräunlich verändert, oder im Rahmen von Einblutungen auch livide imponieren. Mikrozystische Anteile zeigen sich bei oberflächlicher Lage als aggregierte, vesikuläre, teils knotig imponierende Haut- und Schleimhautveränderungen unterschiedlichen Kolorits. Typisch für die lymphatische Malformation ist eine schmerzhafte Schwellungszunahme im Zusammenhang mit Entzündungen oder Infekten, im Rahmen derer es auch zu Einblutungen kommen kann [4–7].
Im Gegensatz zu Low-Flow-Malformationen ist bei High-Flow-Malformationen ein deutliches Schwirren auskultierbar oder eine Pulsation über der Malformation zur tasten. Im Vergleich zu den Low-Flow-Malformationen lässt sich meist eine Überwärmung der darüberliegenden Haut feststellen. Bei arteriovenösen Malformationen kann es im fortgeschrittenen Stadium über eine Minderperfusion des umgebenden Gewebes („Steal-Effekt“) zu einer Ischämie mit atrophischen und ulzerösen Veränderungen der darüberliegenden Haut kommen, mit der Gefahr konsekutiver, rezidivierender Blutungen [8, 10].
Infantile Hämangiome imponieren meist als kurz nach der Geburt auftauchende, hellrote, teils erhabene Maculae mit umgebenden Teleangiektasien, welche in den ersten Lebensmonaten an Größe zunehmen. Das Größenausmaß reicht von stecknadelgroßen Papeln bis zu ausgedehnten, plaque- oder beerenartigen Veränderungen [9].
Apparative Diagnostik
Zur weiterführenden Diagnostik eignet sich bei vaskulären Anomalien zunächst die farbkodierte Duplexsonografie. Hiermit lassen sich Vaskularisierung, Flusseigenschaften, Tiefenausdehnung oder strukturelle Veränderung (z. B. Nachweis von Phlebolithen) bereits orientierend beurteilen [8, 9].
Für die weitere Charakterisierung und Therapieplanung ist bei vaskulären Malformationen die kontrastmittelgestützte MRT-Diagnostik das Mittel der Wahl. Für die Darstellung und Beurteilung der Ausdehnung von venösen und lymphatischen Malformationen eignen sich am besten die kontrastmittelverstärkten T1-gewichteten sowie T2-gewichteten, fettsupprimierten Sequenzen. Mittels erweiterter MRT-Diagnostik mit Gefäßdarstellung (MRT-Angiografie) gelingt zusätzlich noch die Darstellung zu- und abfließender Gefäße. Charakteristisch für venöse Malformationen ist die Signalverstärkung nach Kontrastmittelgabe in den T1-gewichteten Sequenzen und der Nachweis von Phlebolithen [4, 8, 11].
Bei Verdacht auf das Vorliegen einer arteriovenösen Malformation empfiehlt sich die zusätzliche Durchführung einer diagnostischen Angiografie zur Identifikation des Nidus, also dem Ort des arteriovenösen Kurzschlusses sowie der zuführenden arteriellen Gefäße („feeder“) bei gleichzeitiger Erfassung der Hämodynamik. Dies ist für die Planung der späteren Therapie von entscheidender Bedeutung [4, 8, 11].
Therapie
Die Therapie richtet sich zum einen nach der Diagnose, dem Alter des Patienten, der Befundausdehnung sowie der klinischen Beschwerdesymptomatik.
Die Therapie der Wahl bei kapillären Malformationen ist die Behandlung mittels gepulstem Farbstofflaser. In seltenen Fällen kann in funktionell und ästhetisch relevanter Lokalisation auch eine lokale Exzision indiziert sein. Der Naevus simplex bedarf bei vollständiger Rückbildungstendenz keiner Therapie [7].
Die Therapie der venösen und lymphatischen Malformationen orientiert sich zumeist an der Befundausdehnung, der klinischen Beschwerdesymptomatik sowie der Lokalisation. Bei ausgedehnten venösen Malformationen sowie makrozystischen lymphatischen Malformationen (zystisches Hygrom) ist die transkutane Sklerosierung des Befundes die Therapie der Wahl. Hierbei werden CT-gestützt Medikamente (u. a. hochprozentiger Alkohol, Polidocanol oder Bleomycin) in die Läsion in-stilliert, was über eine entzündliche Reaktion zur Vernarbung und Schrumpfung der Malformation führt. Bei ausgedehnten und/oder mehrkammerigen Befunden sind oft mehrere Therapiesitzungen erforderlich und zu einem späteren Zeitpunkt kann eine chirurgische Entfernung verbliebener Residuen notwendig werden. Bei umschriebenen und gut abgrenzbaren Malformationen kann auch eine primär chirurgische Therapie angezeigt sein (Abb. 1). Mikrozystische lymphatische Malformationen (Lymphangiome) sind einer Sklerosierungstherapie oft nicht zugänglich, weshalb eine chirurgische Resektion oder Reduktion oft die einzige Therapiemöglichkeit darstellt [6, 8, 10].

Abb. 1 a–d: a) Ausgedehnte lymphatische Malformation (Hygrom) cervical/fazial rechts bei 2 Monate altem Säugling b) Intraoperativer Befund nach Tumorexstirpation c) Kontrolle 4 Monate postoperativ d) Endergebnis, 2 Jahre nach Operation.
Bei arteriovenösen Malformationen ist zunächst eine transfemorale Embolisierung des Gefäßnidus erforderlich (u. a. mit Flüssigembolisaten (Onyx, n-BCA) oder PVA-Partikeln), um den arteriellen Zufluss zu unterbinden. Ziel der Behandlung ist eine vollständige Okklusion des AVM-Nidus, um Rezidive über die Entstehung von Kollateralkreisläufen zu vermeiden. Anschließend muss eine vollständige chirurgische Resektion der Gefäßmalformation angestrebt werden, da es bei unvollständiger Entfernung zur Stimulation und Expansion des Restnidus kommen kann. Bei ausgedehnten Befunden mit Beteiligung der darüberliegenden Haut kann es somit zu großen Defekten kommen, die eine aufwendige primäre oder sekundäre Rekonstruktion erforderlich sein (Abb. 2). Arteriovenöse Fisteln werden meist mit „Coils“ oder „Vascular Plugs“ verschlossen [8, 10, 12].
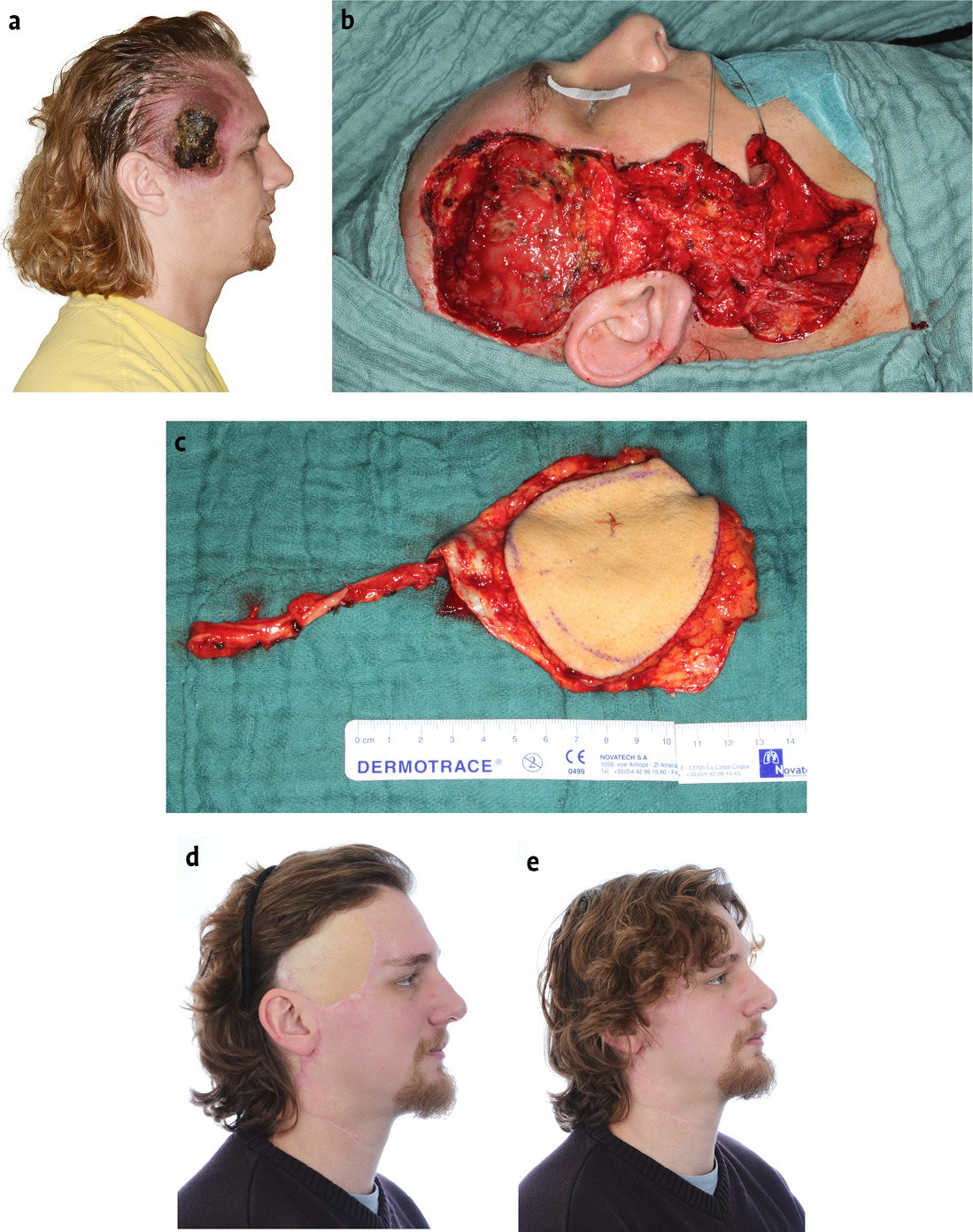
Abb. 2 a-e: Resektion einer arteriovenösen Malformation temporal rechts nach erfolgter Embolisation sowie Rekonstruktion mittels mikrovaskulär reanastomosiertem Transplantat vom anterolateralen Oberschenkel.
Da bei Hämangiomen im Laufe der ersten ein bis zwei Lebensjahre eine spontane Regression eintritt, sollte aus chirurgischer Sicht zunächst ein abwartendes Verhalten gewählt werden. Die Therapie von Hämangiomen beschränkt sich meist auf ausgedehnte Befunde mit rascher Größenprogredienz oder Hämangiome in kritischer Lokalisation mit ästhetischer oder funktioneller Beeinträchtigung. Neben der lokalen Kryo- und Farbstofflasertherapie, deren Anwendung sich auf kleinere Befunde mit geringer Tiefenausdehnung beschränkt, hat sich die frühzeitige orale und topische Propranololtherapie als Standardverfahren bei ausgedehnteren Befunden etabliert. Die systemische Kortisontherapie oder die interstitielle Lasertherapie (Nd:YAG-Laserbehandlung) hat mittlerweile an Bedeutung verloren. Auf eine chirurgische Therapie wird meist nur dann zurückgegriffen, wenn die konventionellen Behandlungsmethoden versagen und deshalb dauerhafte funktionelle Einschränkungen drohen, zur Entfernung von Residuen nach erfolgreicher Primärtherapie oder im Verlauf zur ästhetischen Korrektur narbiger Veränderungen. Bei den deutlich selteneren kongenitalen Hämangiomen ohne Regressionstendenz (NICH, „non-involuting congenital haemangioma“) kann ebenfalls eine chirurgische Primärtherapie indiziert sein [7, 9].
Literatur
[1] Yakes, W., et al., Gefäßmalformationen, in Operative und interventionelle Gefäßmedizin, E.S. Debus and W. Gross-Fengels, Editors. 2019, Springer Berlin Heidelberg: Berlin, Heidelberg. p. 1–14.
[2] MacFie, C.C. and S.L. Jeffery, Diagnosis of vascular skin lesions in children: an audit and review. Pediatr Dermatol, 2008. 25(1): p. 7–12.
[3] Mulliken, J.B. and J. Glowacki, Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg, 1982. 69(3): p. 412–22.
[4] Sadick, M., et al., Vascular Anomalies (Part I): Classification and Diagnostics of Vascular Anomalies. Rofo, 2018. 190(9): p. 825–835.
[5] McCuaig, C.C., Update on classification and diagnosis of vascular malformations. Curr Opin Pediatr, 2017. 29(4): p. 448–454.
[6] Wiegand, S. and J.A. Werner, Lymphatische Malformationen im Kopf-Hals-Bereich. HNO, 2016. 64(2): p. 133–142.
[7] Theiler, M., R. Walchli, and L. Weibel, Vascular anomalies – a practical approach. J Dtsch Dermatol Ges, 2013. 11(5): p. 397–405.
[8] Clemens, R.K., et al., Vascular malformations revisited. Vasa, 2015. 44(1): p. 5–22.
[9] Schmittenbecher, P.P., Bei der Hämangiom-Therapie up to date. pädiatrie: Kinder- und Jugendmedizin hautnah, 2011. 23(2): p. 95–98.
[10] Nosher, J.L., et al., Vascular anomalies: A pictorial review of nomenclature, diagnosis and treatment. World J Radiol, 2014. 6(9): p. 677–92.
[11] Brahmbhatt, A.N., K.A. Skalski, and A.A. Bhatt, Vascular lesions of the head and neck: an update on classification and imaging review. Insights Imaging, 2020. 11(1): p. 19.
[12] Kansy, K., et al., Interdisciplinary treatment algorithm for facial high-flow arteriovenous malformations, and review of the literature. J Craniomaxillofac Surg, 2018. 46(5): p. 765–772.
Oßwald F, Engel M, Möhlenbruch M, Hoffmann J: Diagnostik und Therapie von Gefäßanomalien im Kopf- und Halsbereich. Passion Chirurgie. 2021 April; 11(04): Artikel 03_01.
Autoren des Artikels
Dr. med. dent. Florian Oßwald
AssistenzarztKlinik und Poliklinik für Mund-, Kiefer- und GesichtschirurgieUniversitätsklinikum HeidelbergIm Neuenheimer Feld 40069120Heidelberg kontaktierenProf. Dr. med. Dr. med. dent. Michael Engel
Geschäftsführender OberarztKlinik und Poliklinik für Mund-, Kiefer- und GesichtschirurgieUniversitätsklinikum Heidelberg kontaktierenPD Dr. med. Markus Möhlenbruch
Oberarzt in der Abteilung für NeuroradiologieLeiter der Sektion Vaskuläre und interventionelle NeuroradiologieUniversitätsklinikum Heidelberg kontaktierenUniv.-Prof. Dr. med. Dr. med. dent. Dr. h.c. Jürgen Hoffmann
Ärztlicher DirektorKlinik und Poliklinik für Mund-, Kiefer- und GesichtschirurgieUniversitätsklinikum Heidelberg kontaktierenWeitere Artikel zum Thema
08.08.2022 Wissen
Ukraine: Nachholbedarf bei Schussverletzungen für deutsche Ärzte
Das wehrmedizinische Wissen ist Deutschland ist offensichtlich ausbaufähig. Viele Operationstechniken im Bereich von Schussverletzungen stammten noch aus der Zeit der Weltkriege.
01.04.2021 Mund-, Kiefer- & Gesichtschirurgie
„The big Four“ – BCC, PEC, MM & MCC: Stadiengerechte Therapie von Hautmalignomen der Kopf-Hals-Region
Kutane Malignome stellen die häufigsten bösartigen Erkrankungen überhaupt dar und zeigen eine seit Jahrzehnten ansteigende Inzidenz. Das Basalzellkarzinom (BZK), das kutane Plattenepithelkarzinom (PEK) sowie das maligne Melanom (MM) sind hierbei die führenden Entitäten. Allen Entitäten gemeinsam ist ätiologisch eine erhöhte UV-Exposition. Das Risiko steigt mit zunehmender UV-Exposition und damit mit dem Alter, wobei als weitere Kofaktoren unter anderem ein heller Hauttyp, Immunkompromittierung, chronische Entzündungen, Noxen und ionisierende Strahlung sowie HPV-Infektion und Genodermatosen hinzukommen können.
01.04.2021 Mund-, Kiefer- & Gesichtschirurgie
Patientenspezifische Implantate in der Gesichtsschädeltraumatologie – welche Indikationen sind sinnvoll?
Bildgebungsbasierte computergestützte Verfahren zur Operationsplanung und -durchführung (sog. „Computergestützte Chirurgie“ bzw. “Computer-assisted Surgery, CAS) haben sich in den letzten Jahren in unterschiedlichen medizinischen Fachbereichen etabliert. Insbesondere chirurgische Fächer wie Orthopädie und Unfallchirurgie, Neurochirurgie, Herzchirurgie und Mund-, Kiefer- und Gesichtschirurgie (MKG-Chirurgie) haben von dieser Entwicklung, die den Operateur bei der Planung und Durchführung chirurgischer Eingriffe unterstützen, profitiert.
31.03.2021 BDC|News
Editorial im April 2021: Mund-, Kiefer- und Gesichtschirurgie
Das Fachgebiet Mund-, Kiefer- und Gesichtschirurgie (MKG) befindet sich an der Schnittstelle zwischen Medizin und Zahnmedizin. Die Facharztausbildung zur Mund-Kiefer-GesichtschirurgIn setzt als einzige den Abschluss zweier Studien voraus, ein Medizin- und ein Zahnmedizinstudium. Klinisch werden PatientInnen aus beiden Bereichen behandelt, die Lehrverpflichtungen betreffen sowohl Zahnmedizin als auch Medizin und auch die Forschung umfasst beide humanmedizinischen Disziplinen.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.